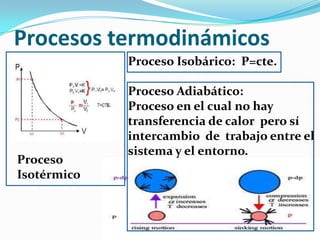
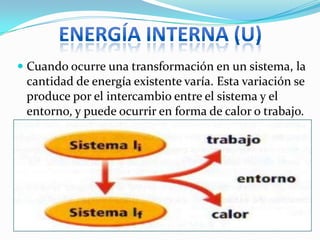
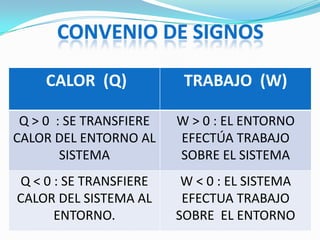
Este documento presenta un resumen de conceptos básicos de termodinámica. Explica que una variable termodinámica describe el estado de un sistema termodinámico y puede ser extensiva o intensiva. Luego define conceptos clave como energía interna, trabajo, calor y el primer principio de la termodinámica, que establece que el cambio de energía interna de un sistema es igual al calor absorbido más el trabajo realizado.