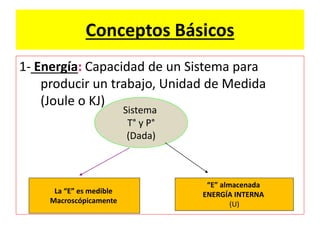
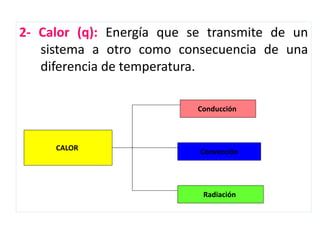
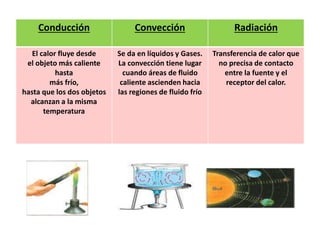
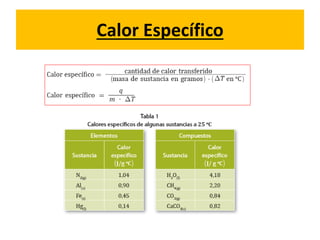
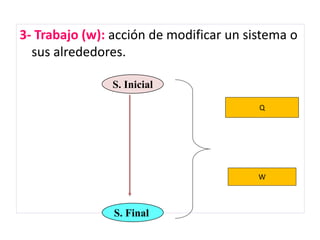
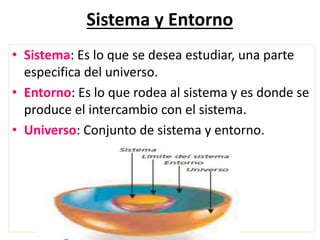
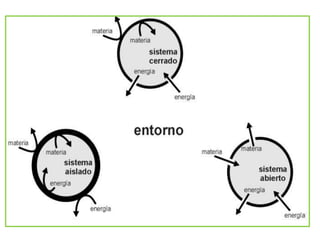
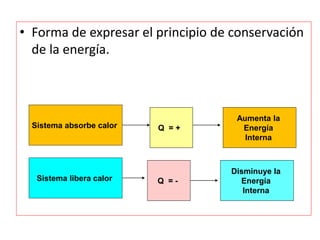
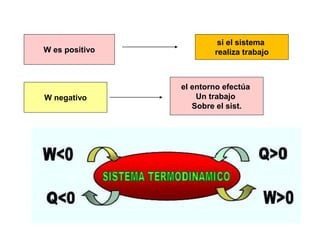
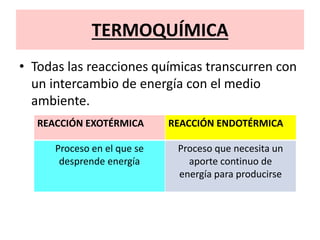
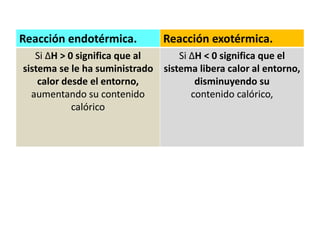
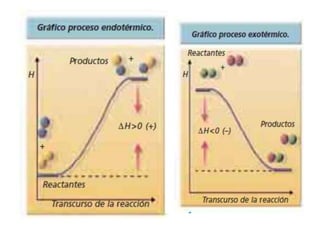
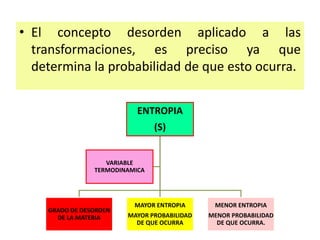
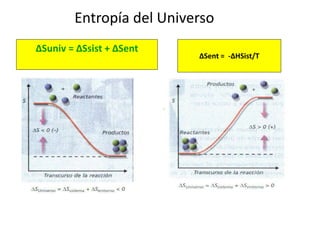
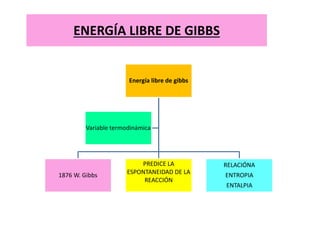
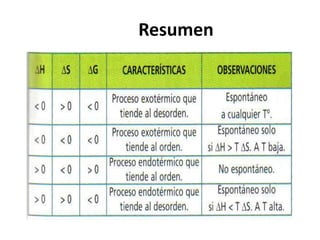
La termodinámica estudia las transformaciones de energía como el calor y el trabajo. Se basa en dos principios: 1) la energía total del universo es constante y 2) el desorden del universo tiende a aumentar. Conceptos clave incluyen energía interna, calor, trabajo, y las leyes de la termodinámica que describen cómo la energía fluye y se transforma durante los procesos físicos y químicos. La espontaneidad de las reacciones químicas puede predecirse mediante el cálculo de la energ