Este documento presenta conceptos clave de termoquímica en 3 oraciones:
1) Explica los diferentes tipos de energía como energía radiante, térmica, química, nuclear y potencial. 2) Define conceptos como calor, temperatura, termoquímica, procesos exotérmicos y endotérmicos. 3) Introduce la Primera Ley de la Termodinámica sobre la conservación de la energía y cómo se aplica a las reacciones químicas exotérmicas y endotérmicas.























![La entalpía estándar de reacción (∆H0) es la entalpía de
rxn
una reacción a 25°C y 1 atm.
aA + bB cC + dD
∆Hrxn = [ c∆H0f (C) + d∆H0f (D) ] - [ a∆H0 (A) + b∆H0 (B) ]
0
f f
∆Hrxn = Σ n∆H0f (productos) Σ m∆Hf0 (reactivos)
0 -
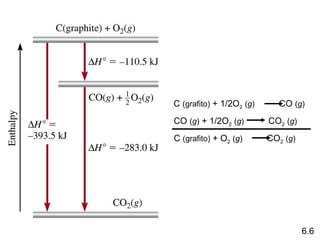
Ley de Hess: Cuando los reactivos son convertidos a
productos, el cambio de entalpía es el mismo si la reacción
ocurre en un paso o en una serie de pasos.
(La entalpía es una función de estado. No importa el
camino tomado, solamente los estados inicial y final.)
6.6](https://image.slidesharecdn.com/captulo06-121003112141-phpapp01/85/Termoquimica-28-320.jpg)
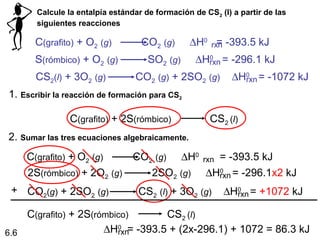
![El benceno (C6H6) se quema en presencia de aire para producir
el dióxido de carbono y el agua líquida. ¿Cuánto calor se libera
por cada mol de benceno quemado? La entalpía estándar de
formación del benceno es 49.04 kJ/mol.
2C6H6 (l) + 15O2 (g) 12CO2 (g) + 6H2O (l)
∆Hrxn = Σ n∆H0f (productos) Σ m∆Hf0 (reactivos)
0 -
∆Hrxn = [ 12∆H0 (CO2) + 6∆H0 (H2O)] - [ 2∆Hf0 (C6H6) ]
0
f f
∆Hrxn = [ 12x–393.5 + 6x–187.6 ] – [ 2x49.04 ] = -5946 kJ
0
-5946 kJ
= - 2973 kJ/mol C6H6
2 mol
6.6](https://image.slidesharecdn.com/captulo06-121003112141-phpapp01/85/Termoquimica-31-320.jpg)


