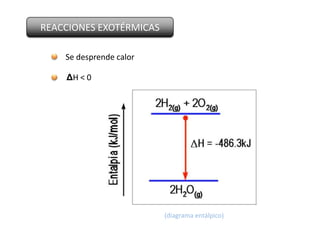
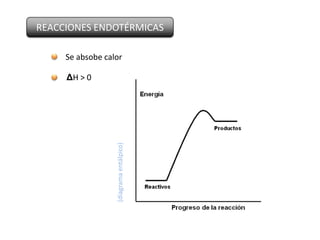
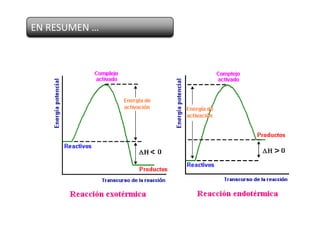
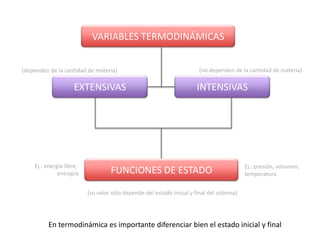
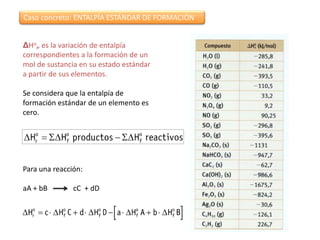
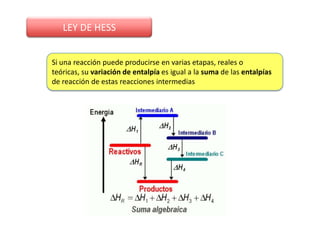
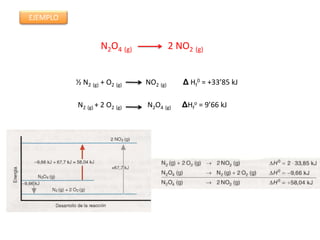
Este documento trata sobre la termoquímica y contiene información sobre los principios de la termodinámica, reacciones exotérmicas y endotérmicas, entalpía, entalpía estándar de reacciones y formación, ley de Hess, y ejemplos y ejercicios de cálculo.