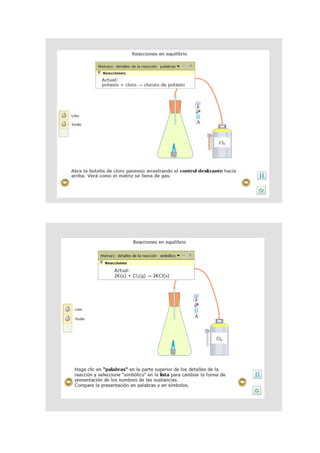
El documento presenta un estudio sobre el equilibrio químico, sus reacciones y factores que influyen en él, como temperatura, presión y concentración. A través de varias actividades interactivas, se exploran conceptos como las reacciones reversibles, la masa molar, y el cálculo del rendimiento de reacciones químicas. Se busca ampliar el conocimiento en procesos químicos y sus respectivas dinámicas para una mejor comprensión en el ámbito de la química.