El documento aborda las reacciones de equilibrio químico, explicando su definición, características y cómo se representan simbólicamente. Se enfoca en la reacción del cloruro de amonio, su síntesis, propiedades físicas y su rol en la escala de temperatura Fahrenheit. Además, se discuten conceptos de masas moleculares y su importancia en química.



![RELACIONES EN EQUILIBRIO
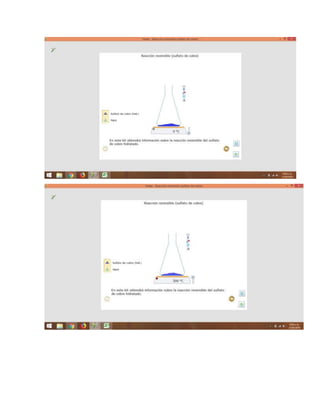
Es la denominación que se hace a cualquier reacción reversible cuando de observa
que las cantidades relativas de dos o más sustancias permanecen constantes, es
decir, el equilibrio químico se da cuando la consetración de las especies
participantes no cambian, de igual manera en esta de equilibrio no se observan
cambios fisicos a medida que trascurre el tiempo, siempre es necesario que exista
una reacción química para que exsta un equilibrio químico, sin racción no sería
posible.
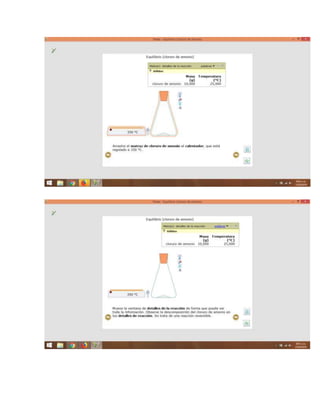
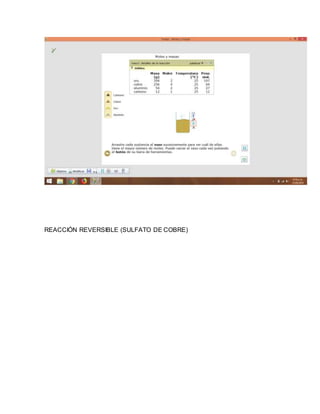
REACCIÓN REVERSIBLE: Una reacción reversible es una reacción
química. Consideramos como ejemplo la reacción de los relativos A y B
que se unen para dar los productos C y D esta puede simbolizarse con la
siguiente ecuación química:
aA + bB → cC + dD
Los coeficientes estequiométricos, es decir, el número relativo de moles de
cada substancia que intervienen en la relación se indican com a,b para los
reactivos y c,d para los productos, mientras que le flecha indica que la
relación puede ocurrir en uno u otro sentido, directo e inverso.
Puesto que la relación puede proceder en ambas direcciones y el sentido
neto de la relación esta definido por la presión, la temperatura y la
consentración relativa de los reactivos y productos en el medio que se
desarrolla, la definicón de reactantes y producto en este tipo de reacciones
es convecional y está dada por el tipo de proceso estudiado.
La Reacción:
aA + bB → cC + dD
cC + dD → aA + bB
aA + bB → cC + dD
V1= K1 [𝐴 𝑎
] [𝐵 𝑏
]
V-1= K-1 [𝐶 𝑐
] [𝐷 𝑑
]
Si las velocidades de ida y vuelta son iguales aparentemente no pasa nada:
K1 [𝐴 𝑎
] [𝐵 𝑏
]= K-1 [𝐶 𝑐
] [𝐷 𝑑
]](https://image.slidesharecdn.com/laboratoriovirtual-190713232404/85/Laboratorio-virtual-4-320.jpg)