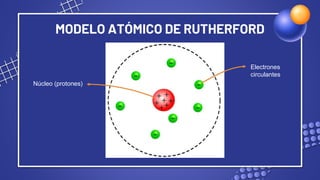
El documento describe el modelo atómico de Rutherford, incluyendo los detalles de su experimento clave. Rutherford propuso que los átomos consisten en un pequeño núcleo positivo rodeado por electrones negativos en órbita. Su experimento mostró que la mayor parte del espacio en un átomo está vacío, con la masa y carga concentradas en el pequeño núcleo central. Este modelo revolucionario estableció la base de nuestra comprensión moderna de la estructura atómica.











![BIBLIOGRAFÍA
● Hierrezuelo, J., Molina, E., Sampedro, C. and Del Valle, V., 2008.
Física y Química 1° Bachillerato. 3rd ed. Granada: Elzevir.
● Chang, R., Overby, J., Nagore, G. and Sarmiento Ortega, S., 2010.
Química. Madrid: McGraw-Hill.
● Soto, F., 2019. Módulo 1 Materia y entorno: La materia del universo.
[online] Epja.mineduc.cl. Disponible en: <https://epja.mineduc.cl/wp-
content/uploads/sites/43/2019/06/Gu%C3%ADas-Ciencias-Naturales-
M%C3%B3dulo-N%C2%B0-1-La-Materia-del-Universo.pdf
● Recursostic.educacion.es. 2022. Fallos en el modelo de Rutherford.
[online] Disponible en:
<http://recursostic.educacion.es/secundaria/edad/4esofisicaquimica/4
quincena8/4q8_contenidos_2d_ampliacion.htm> [Accessed 12 June
2022].](https://image.slidesharecdn.com/modeloatmicoderutherford-220627024931-8f6fd839/85/Modelo-atomico-de-Rutherford-pptx-13-320.jpg)
