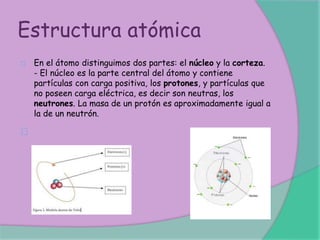
Este documento presenta la información de 4 integrantes de un grupo de trabajo: Alejandra Pincay, Diana Moncada, Andrés Salazar y Anthony Romero. Además, incluye varios párrafos sobre la evolución de los modelos atómicos, incluyendo los modelos de Rutherford, Bohr y Schrödinger, así como sobre la estructura atómica, isótopos y otros temas relacionados con la física atómica.