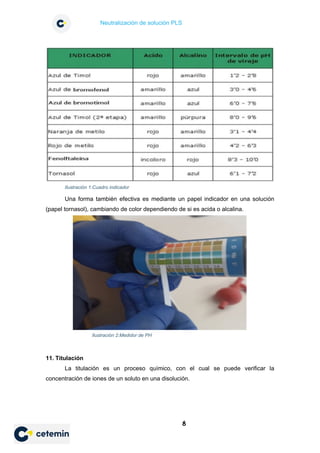
Este documento presenta los conceptos y procedimientos para realizar la neutralización de una solución PLS mediante una titulación ácido-base. Explica brevemente la química de soluciones, concentraciones, ácidos, bases y pH. Luego detalla el procedimiento de titulación volumétrica para neutralizar la solución PLS, incluyendo la medición del volumen de HCl requerido para lograr un pH específico. Finalmente, resume los pasos experimentales llevados a cabo por los estudiantes para completar con éxito el












![Neutralización de solución PLS
13
moléculas de agua, esta es conocida como la reacción química formada de un ácido
con una base.
Las reacciones de neutralización son comúnmente exotérmicas, lo que significa
que desprenden su energía en forma de calor. En las reacciones químicas los cuerpos
o sustancias experimentan transformaciones que alteran su composición así dando
origen a unas sustancias nuevas. Empiezan haber cambios en sus propiedades, las
cuales experimentan cambios que son los reactivos y los que se forman productos. De
las reacciones químicas formado por un ácido base se obtienen compuestos llamados
sales.
16. Neutralización de ácidos y bases
La reacción entre un ácido y una base se denomina neutralización. Según el
carácter del ácido y de la base reaccionante se distinguen cuatro casos:
ácido fuerte + base fuerte ácido débil + base fuerte ácido fuerte + base débil
ácido débil + base débil
En el momento de la neutralización se cumple que el número de equivalentes de
ácido que han reaccionado (N • V) es igual al número de equivalentes de la base (N' •
V'):
𝑵𝑵 × 𝑽𝑽 = 𝐍𝐍′ × 𝐕𝐕′
16.1. Neutralización: Ácido Fuerte + Base Fuerte
Cuando un ácido fuerte se neutraliza con una base fuerte, el pH experimenta una
brusca variación justamente en el punto de equivalencia.
Tomemos por ejemplo una disolución 0,1N de HCl. La [H+] es 10-1 M, y el pH=1.
Si se añade 0,1N NaOH, los OH- consumen los H+ para originar agua. Cuando se han
neutralizado 9/10 partes del ácido, [H+]=10-2 M y pH=2. Si se han neutralizado 999/1000
partes del ácido, [H+]=10-4 M y el pH=4. Basta entonces añadir 2/1000 partes de NaOH
para neutralizar todo el ácido y originar un exceso de iones OH-, que estarán a una
concentración 10-4 M, y un pH=10.
16.2. Neutralización: Ácido Fuerte + Base Débil
Cuando un ácido fuerte como el HCl se neutraliza con una base débil (NH3), el
pH se mantiene muy bajo mientras aún existe ácido libre y después de alcanzar la
neutralidad, el ligero exceso de NH3 eleva paulatinamente el pH, sin provocar cambios
bruscos (Figura de la derecha). En este caso, en el punto de equivalencia (igual número
de equivalentes de ácido y de base) el pH](https://image.slidesharecdn.com/presentacinfinal-2-220425171246/85/Neutralizacion-y-titulacion-pls-14-320.jpg)