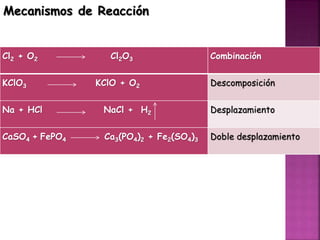
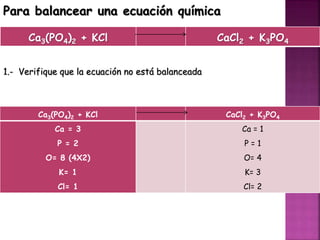
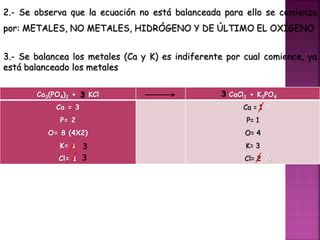
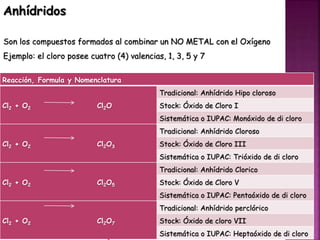
El documento define tres tipos de nomenclatura química: tradicional, Stock y IUPAC. Explica cada una de estas nomenclaturas y cómo se aplican para nombrar óxidos, anhídridos, hidróxidos, ácidos, sales y otros compuestos. También describe los mecanismos de reacción como combinación, descomposición, desplazamiento y doble desplazamiento.








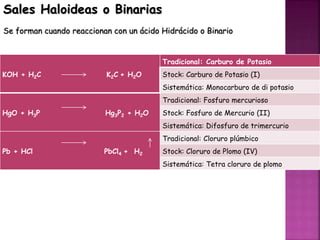
![Sales Oxisales o Terciarias
Se forman al reaccionar con un ácido oxácido y la terminación OSO cambia a ITO y
el ICO cambia para ATO
KOH + H2CO3 K2CO3 + H2O
Tradicional: carbonato de potasio
Stock: Carbonato de Potasio (I)
Sistemática: Tri oxo carbonato (IV) de di potasio
HgO + H3PO3 Hg3(PO3)2 + H2O
Tradicional: Fosfito mercurioso
Stock: Fosfito de Mercurio (II)
Sistemática: Dis [Tri oxo fosfato (III)] de trimercurio
Pb + HClO2 Pb(ClO2)4 + H2
Tradicional: Hipoclorito plumbico
Stock: hipoclorito de Plomo (IV)
Sistemática: Tetris [Di oxo clorato (I)] de plomo](https://image.slidesharecdn.com/nomenclatura2021-1-211221101022/85/Nomenclatura-13-320.jpg)