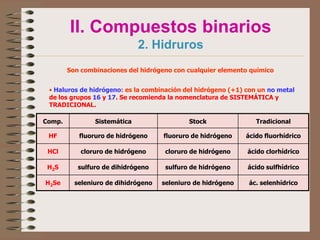
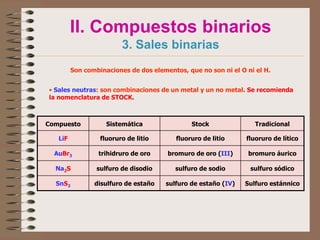
Este documento trata sobre la nomenclatura y formulación de compuestos inorgánicos. Explica conceptos como valencia, número de oxidación y tipos de compuestos como binarios, ternarios y sales. Detalla los sistemas de nomenclatura (sistemática, stock y tradicional) y cómo nombrar diferentes tipos de compuestos como óxidos, hidruros, oxoácidos e iones según las reglas de la IUPAC.