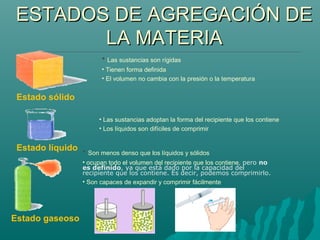
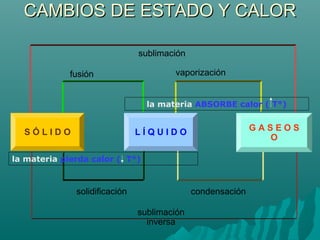
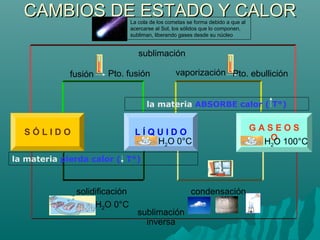
Este documento trata sobre la química y la materia. Explica que la química estudia los materiales que constituyen el universo, su estructura y propiedades, así como los cambios que experimentan. Describe los diferentes estados en que puede encontrarse la materia (sólido, líquido y gaseoso), y los cambios de estado asociados al calor, como la fusión, evaporación y solidificación.