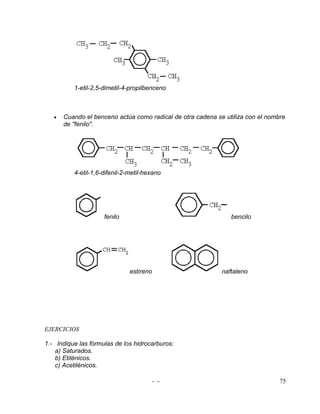
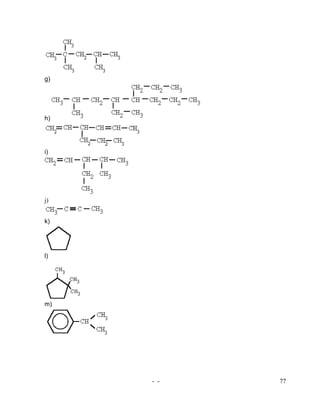
El documento aborda conceptos fundamentales de química, incluyendo la definición de materia, sus propiedades y clasificación, además de las ramas de la química. Se explican los estados de la materia, cambios de estado y fenómenos físicos y químicos, proporcionando una base para el estudio de la estructura atómica y la teoría de átomos, protones, neutrones y electrones. Finalmente, se describen isótopos, isóbaros y la configuración de electrones en los átomos.




























































![UNIDADES QUÍMICAS
1.- Molaridad (M): La molaridad de una solución expresa el número de moles de
moléculas del soluto por litro de solución.
2.- Normalidad (N): La normalidad de una solución indica el número de equivalentes
gramo de soluto por litro de solución.
3.- Molalidad (m): Es número de moles de soluto por cada kg de disolvente contenido
en una solución.
4.- Fracción molar (X): Es igual al número de moles de un componente, dividido por
el número de moles de todos los componentes existentes en la solución.
La suma de las fracciones molares de todos los componentes de una solución es
igual a 1
X soluto + X solvente = 1
n soluto
X soluto = ————————— ( soluciones binarias )
n soluto + n solvente
n solvente
X solvente = —————–——— ( soluciones binarias )
n soluto + n solvente
Donde:
X soluto : fracción molar de soluto
X solvente : fracción molar de solvente
n soluto : número de moles de soluto [ mol ]
n solvente : número de moles de solvente [ mol ]
PROBLEMAS RESUELTOS
- - 61](https://image.slidesharecdn.com/textodequimica-090704155330-phpapp01/85/Texto-De-Quimica-61-320.jpg)