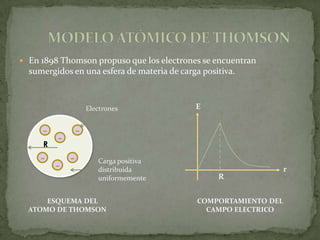
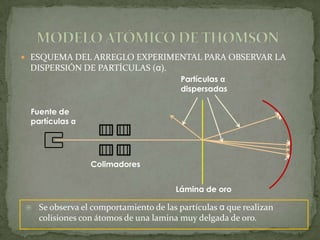
1) Los modelos atómicos griegos y de Dalton no tenían evidencia experimental.
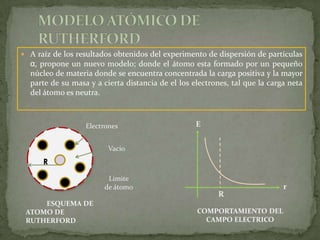
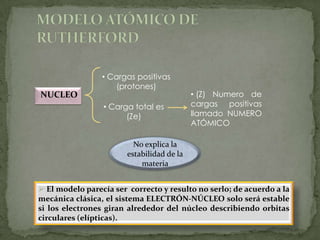
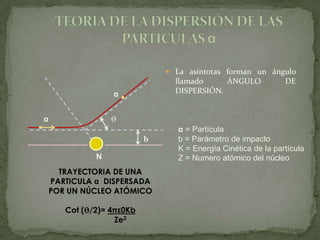
2) Rutherford propuso que los átomos tienen un núcleo positivo concentrado con electrones orbitando, basado en experimentos de dispersión de partículas alfa.
3) Bohr aplicó la hipótesis de cuantización de Planck al átomo de hidrógeno, explicando sus estados estacionarios y energéticos discretos.