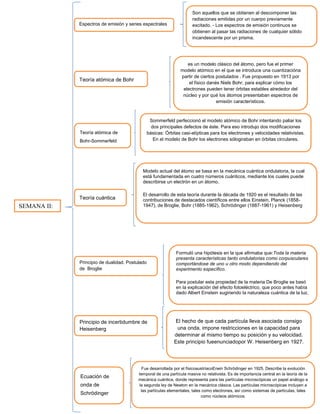
Los espectros de emisión son espectros obtenidos al descomponer las radiaciones emitidas por un cuerpo previamente excitado. La teoría atómica de Bohr explica cómo los electrones pueden tener órbitas estables alrededor del núcleo y por qué los átomos presentaban espectros de emisión característicos. La teoría cuántica, desarrollada en la década de 1920, se basa en la mecánica cuántica ondulatoria y está fundamentada en cuatro números cuánticos.