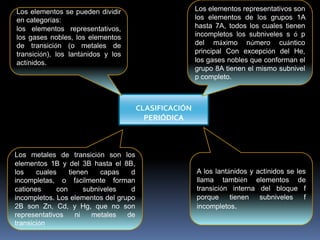
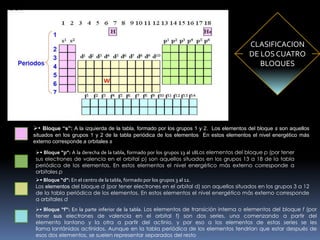
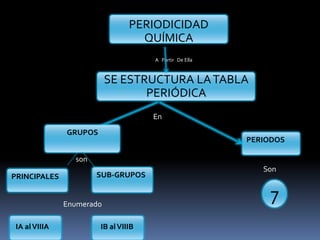
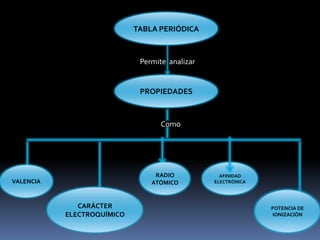
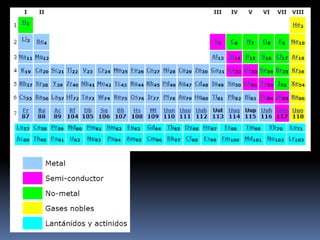
El documento resume la historia y desarrollo de la tabla periódica de los elementos. En 1869, Dimitri Mendeleev y Lothar Meyer publicaron de forma independiente las primeras tablas periódicas ordenando los elementos conocidos según sus propiedades. Más tarde, en 1913, Moseley ordenó los elementos usando el número atómico como criterio, enunciando la ley periódica. La tabla periódica actual ordena los elementos en 18 columnas de grupos y 7 filas de períodos, permitiendo analizar propiedades periódicas como la