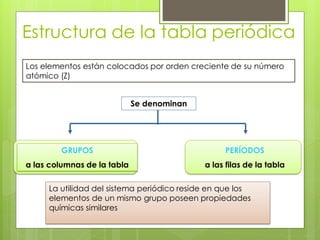
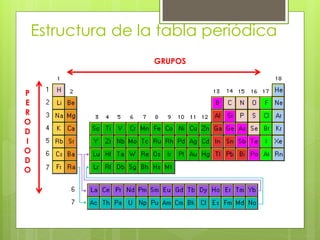
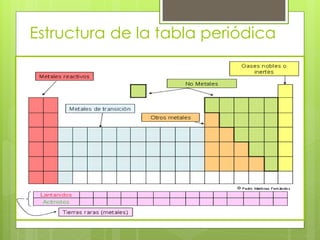
(1) La tabla periódica organiza todos los elementos químicos en orden de número atómico creciente y los agrupa en familias con propiedades similares. (2) Ha evolucionado a lo largo de la historia con contribuciones como las tríadas de Döbereiner y la tabla de Mendeleev que ordenaba los elementos principalmente por masa atómica. (3) Actualmente, los elementos se ordenan por número atómico gracias a los trabajos de Moseley y se agrupan en grupos y períodos que reflejan sus propiedades qu