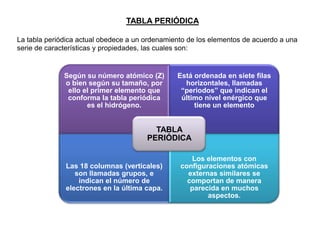
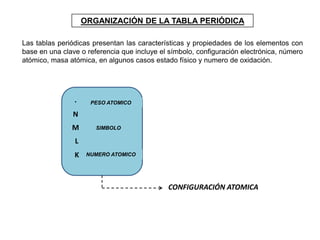
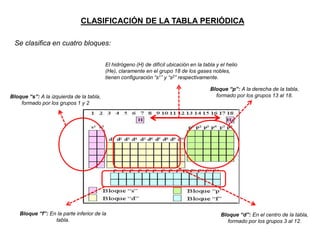
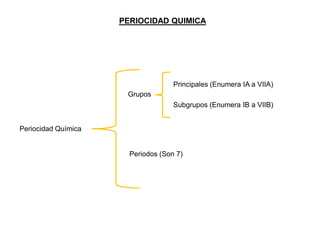
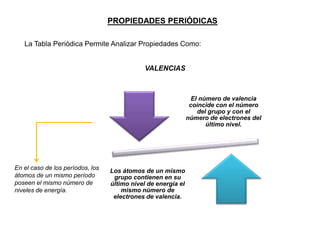
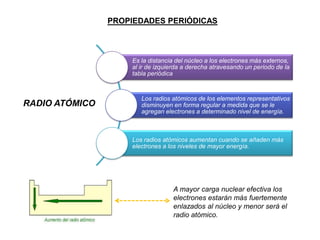
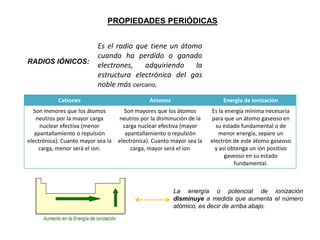
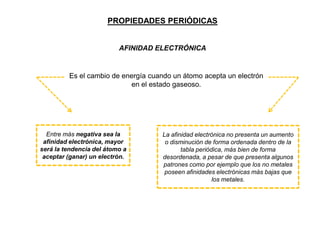
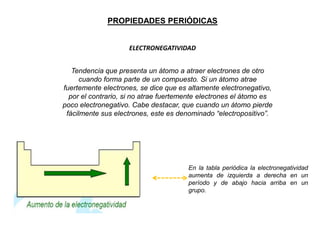
Este documento presenta una introducción a la tabla periódica, incluyendo su historia, organización, clasificación y propiedades periódicas. Explica que la tabla periódica ordena los elementos de acuerdo a su número atómico y propiedades recurrentes. Describe las características de los periodos, grupos y bloques, y cómo varían propiedades como los radios atómicos, energía de ionización y electronegatividad a través de la tabla.