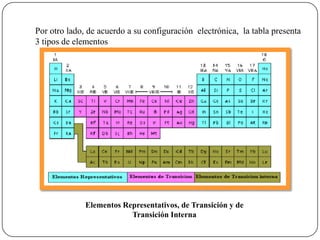
Este documento describe la tabla periódica de los elementos, incluyendo su historia, estructura y clasificación de elementos. Explica que la tabla se organiza en función del número atómico creciente de los elementos y que elementos con propiedades similares se agrupan en columnas verticales. Identifica tres tipos principales de elementos - representativos, de transición y de transición interna - dependiendo de su configuración electrónica.