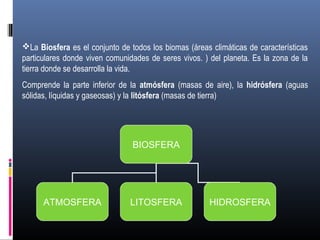
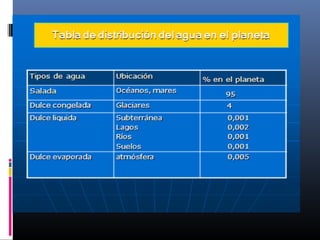
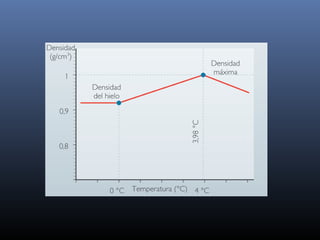
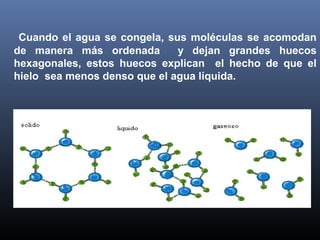
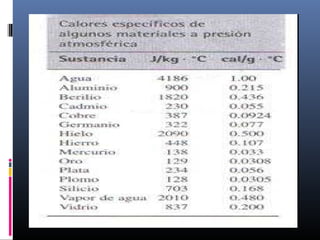
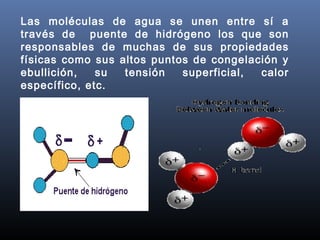
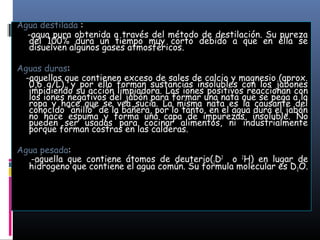
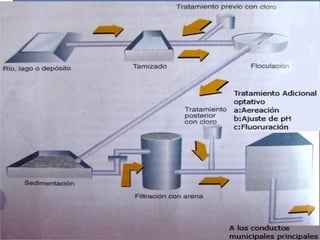
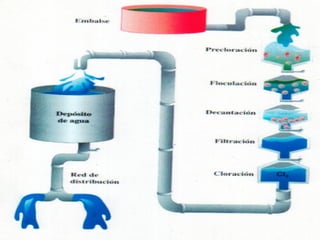
La biósfera incluye la atmósfera, la hidrósfera, y la litósfera. La hidrósfera se refiere al agua en sus tres estados y desempeña un papel crucial en la regulación climática y en hacer posible la vida debido a sus propiedades únicas como su alta capacidad calorífica y su comportamiento anómalo al congelarse. El agua se somete a un proceso de potabilización que incluye tamizado, coagulación, sedimentación, filtración y cloración para eliminar impurezas y