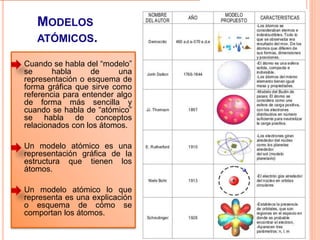
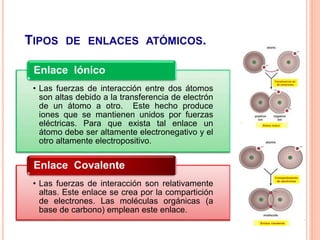
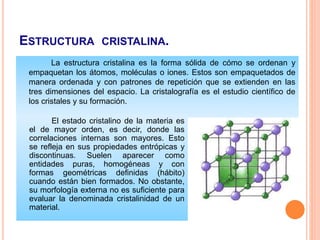
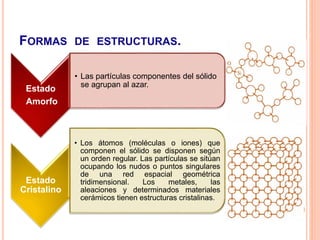
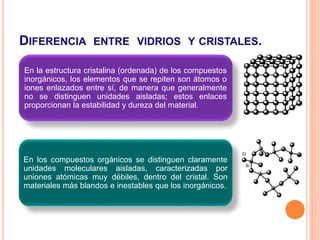
La estructura cristalina describe cómo los átomos se ordenan en un sólido. Los átomos se empaquetan de forma ordenada en una red tridimensional que se repite, formando una celda unitaria. Existen diferentes tipos de celdas unitarias y estructuras cristalinas dependiendo del tipo de enlace atómico y la posición de los átomos. Los cristales se diferencian de los vidrios en que sus átomos presentan un orden repetitivo a larga escala.