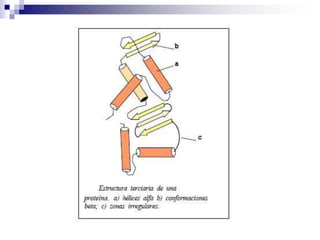
Las proteínas son macromoléculas formadas por aminoácidos, con funciones específicas que se determinan por su estructura primaria, la cual a su vez afecta a sus niveles estructurales superiores. Los aminoácidos esenciales deben obtenerse de la dieta y se conectan entre sí a través de enlaces peptídicos para formar péptidos y proteínas, que pueden clasificarse según su forma y función. La desnaturalización de las proteínas puede resultar en la pérdida de su funcionalidad, y estas realizan diversas funciones en los organismos, incluyendo roles estructurales y enzimáticos.