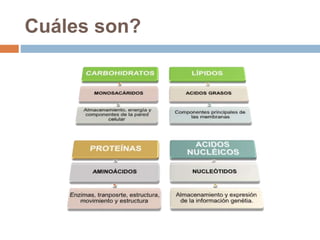
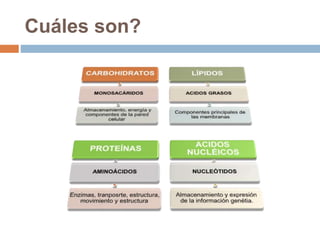
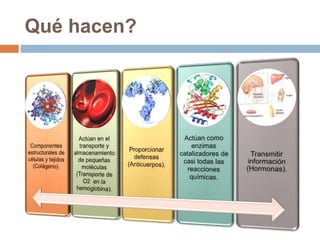
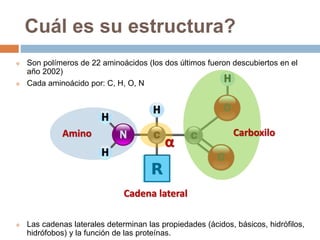
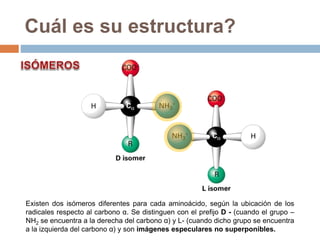
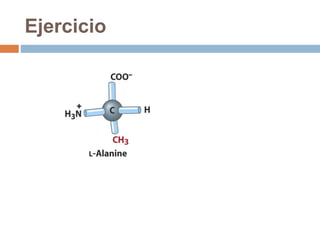
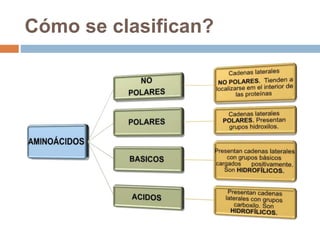
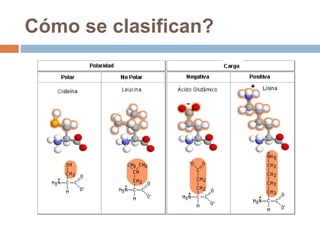
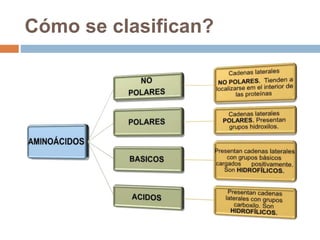
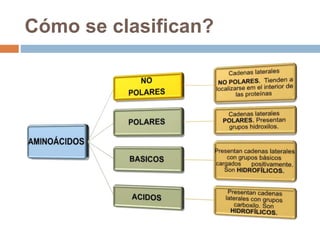
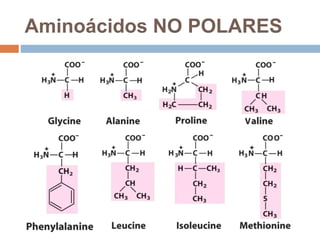
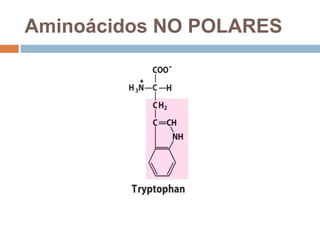
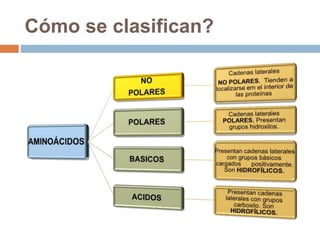
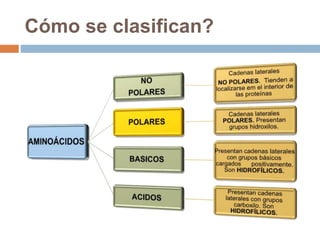
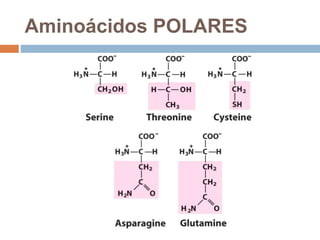
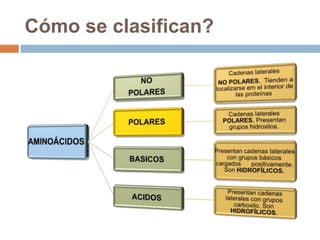
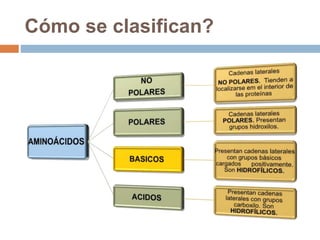
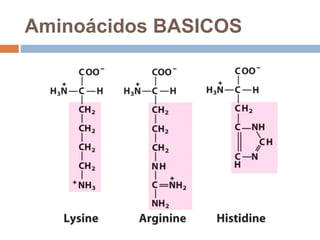
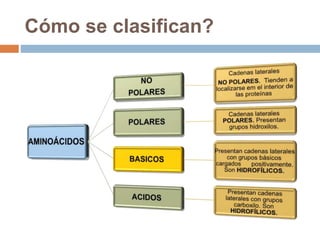
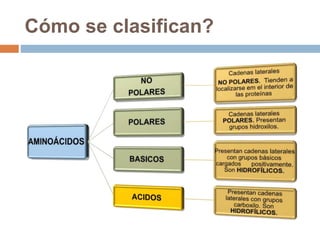
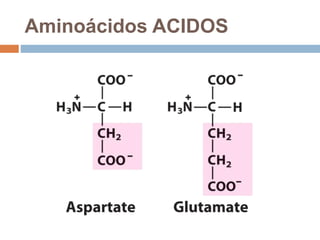
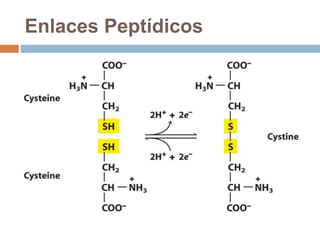
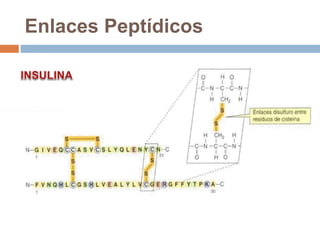
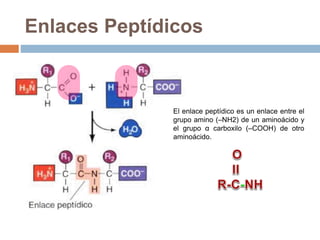
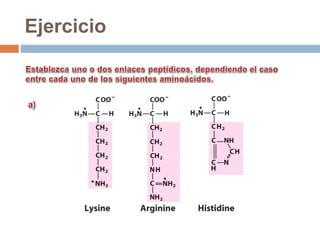
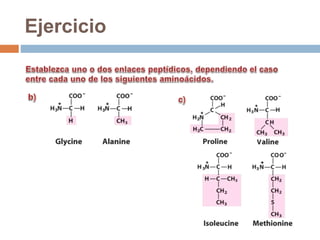
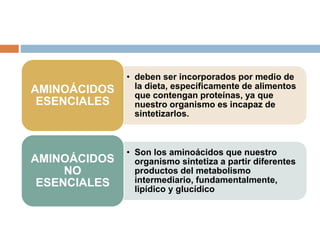
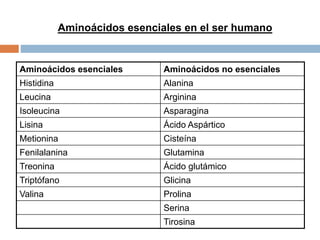
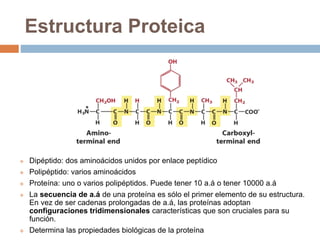
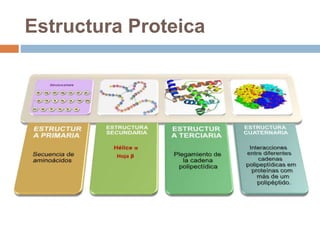
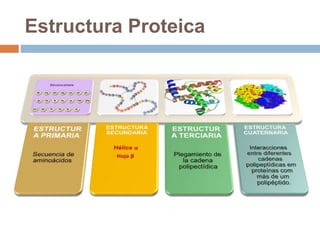
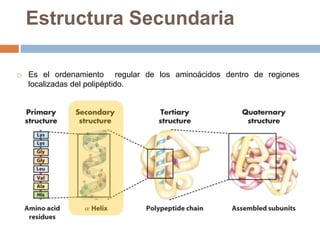
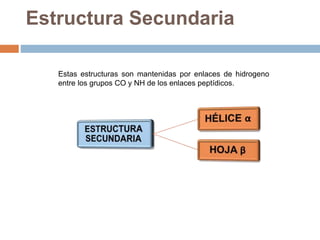
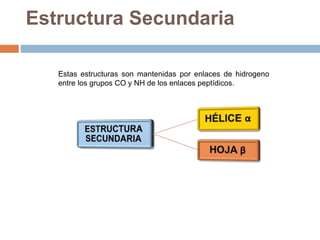
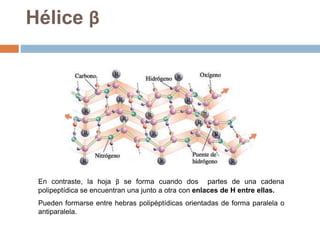
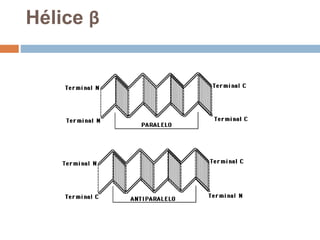
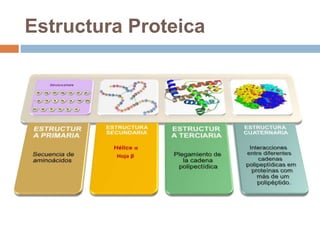
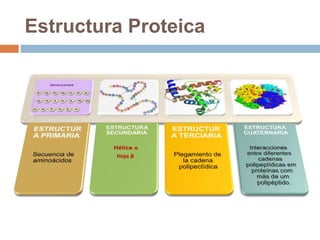
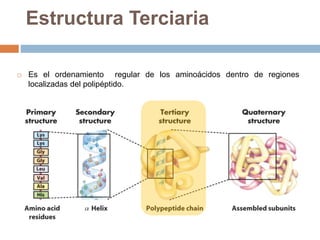
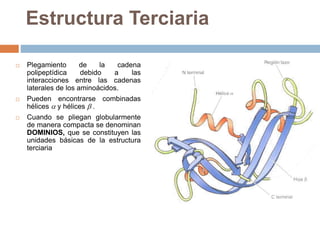
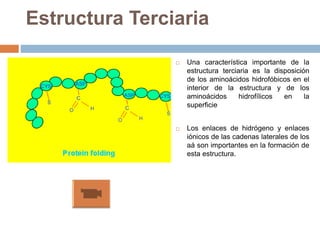
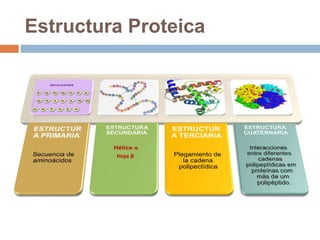
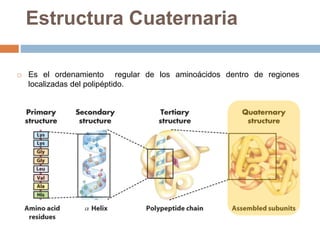
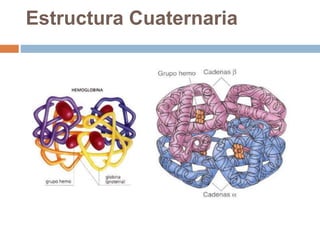
Este documento describe las macromoléculas llamadas proteínas. Explica que están compuestas por cadenas de aminoácidos unidos por enlaces peptídicos y adoptan estructuras secundarias, terciarias y cuaternarias. También clasifica los aminoácidos y describe las diferentes estructuras y funciones de las proteínas, como funciones estructurales, enzimáticas y de transporte.