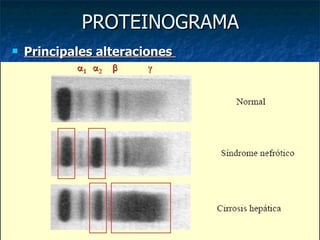
Este documento describe los métodos de fraccionamiento proteico, incluyendo las proteínas plasmáticas como el suero, la síntesis y degradación de proteínas, la estructura de las proteínas, y la metodología de electroforesis. También resume las principales fracciones proteicas como la albúmina, globulinas, e inmunoglobulinas, y explica cómo se analizan y cuantifican las proteínas totales y las alteraciones más comunes en el proteinograma.




































![PROTEINOGRAMA Inmunoglogulinas (LCR) IgG < 40 mg/L Otras Ig muy inferior ↑ [Igs]: Aumento Ig en suero Alteración de la BHE Aumento de síntesis local Procendencia : Razón de IgG y diversos índices Permiten conocer si existe un ↑ss.Intratecal de las Ig. IgG: presencia y actividad de LB locales (E. desmielinizantes). IgM: aparición más precoz en la RI: diagnóstico y seguimiento de procesos infecciosos e inflamatorios del SNC. IgA: ofrece poco valor clínico en enfermedades neurológicas.](https://image.slidesharecdn.com/proteinograma-110328053940-phpapp01/85/Proteinograma-38-320.jpg)







