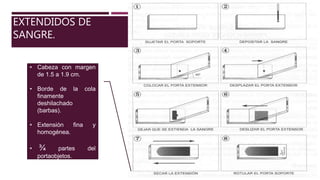
El documento describe el proceso para realizar un recuento diferencial de leucocitos mediante un frotis y tinción de Wright. Se detallan los materiales, el procedimiento de tinción y los resultados esperados, así como los valores normales de los diferentes tipos de leucocitos. Además, se resalta la importancia de la fijación y el adecuado manejo de las muestras para asegurar resultados precisos.