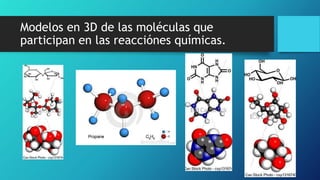
Este documento trata sobre las reacciones de oxidación y reducción. Explica la definición de corrosión y cómo ocurre a través de una reacción electroquímica. También menciona que a nivel mundial se disuelven 5 toneladas de acero cada pocos segundos debido a la corrosión. Finalmente, enumera diferentes métodos para controlar la corrosión como utilizar materiales resistentes y eliminar el oxígeno de las soluciones.