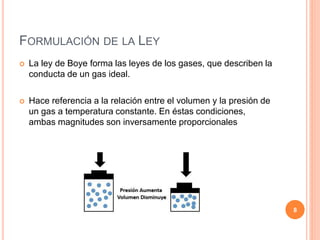
Este documento presenta un resumen de tres páginas sobre las leyes de los gases. Explica las leyes de Boyle, Charles y Gay-Lussac, así como la ley general de los gases y los gases ideales. Incluye ejemplos de problemas y sus soluciones para ilustrar cada ley. El documento concluye explicando que las leyes describen el comportamiento de los gases y su relación entre variables como la presión, el volumen y la temperatura.













![PROBLEMA DE LA LEY DE CHARLES
Una muestra del gas dióxido de nitrógeno [NO2(g)], ocupa 5.1 L a 90 °C. Calcula
el volumen que ocupará el gas a 132 °C, si la presión se mantiene constante (P =
760 torr).
Solución
V = kT
si la masa del gas y la presión permanecen constantes el k es el mismo por lo que
se puede decir lo siguiente:
(V1/T1) = (V2/T2)
Parece ser que este es el caso de nuestro ejercicio
(5.1 Litros/90°C) = (V2/132°C)
Pero esto no se cumple y esto lo observo Jacques Charles y si ves la ley de
Charles esto es debido a que la temperatura debe ser tomada en Kelvins, ya que
esta escala de temperatura esta directamente relacionada con la energía interna
del sistema y por ello también es conocida como una de las escalas absolutas,
teniendo en cuenta esto la ecuación se transforma en la siguiente:
(5.1 Litros/363.15 K) = (V2/405.15K)
V2 = (5.1 L * 405.15K)/363.15K
V2 = 5.69 Litros
https://www.youtube.com/watch?v=hzC3HYozKkg
15](https://image.slidesharecdn.com/quimica1-150309214500-conversion-gate01/85/Quimica-1-15-320.jpg)












