El documento resume los conceptos clave del equilibrio químico, incluyendo la constante de equilibrio Kc, los cálculos con Kc, la relación entre Kc y la constante de presión de equilibrio Kp, y los factores que afectan las concentraciones en el equilibrio. Proporciona ejemplos para ilustrar cada uno de estos conceptos.



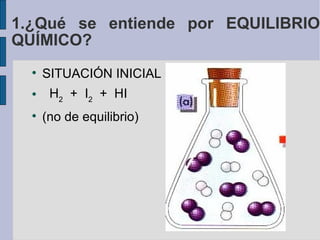
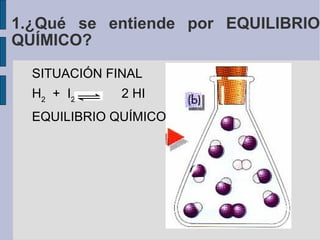

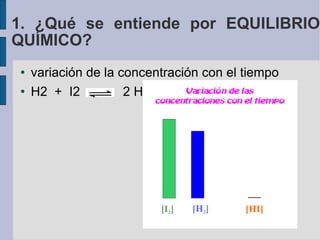
![variación de la concentración con el tiempo H2 + I2 2 HI 1. ¿Qué se entiende por EQUILIBRIO QUÍMICO? Equilibrio químico Concentraciones (mol/l) Tiempo (s) [HI] [I 2 ] [H 2 ]](https://image.slidesharecdn.com/quimica2bachilleratot5equilibrio-110328144211-phpapp01/85/Quimica-2-bachillerato-T5-equilibrio-7-320.jpg)

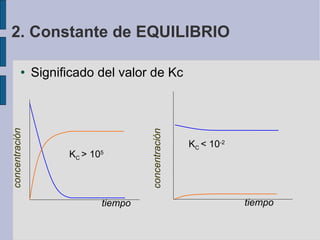
![2.Constante de EQUILIBRIO SO 2 (g) + O 2 (g) + SO 3 (g) 2 SO 2 (g) + O 2 (g) 2 SO 3 (g) 280,6 0,363 0,343 0,037 0,25 0,40 0,15 Exp 5 280,5 0,568 0,066 0,132 0,70 — — Exp 4 280,0 0,143 0,026 0,053 0,20 — — Exp 3 280,7 0,135 0,332 0,014 — 0,40 0,15 Exp 2 279,2 0,170 0,155 0,030 — 0,20 0,20 Exp 1 K c [SO 3 ] [O 2 ] [SO 2 ] [SO 3 ] [O 2 ] [SO 2 ] Concentr. equilibrio (mol/l) Concentr. iniciales (mol/l)](https://image.slidesharecdn.com/quimica2bachilleratot5equilibrio-110328144211-phpapp01/85/Quimica-2-bachillerato-T5-equilibrio-10-320.jpg)
![2.Constante de EQUILIBRIO 2 SO 2 (g) + O 2 (g) 2 SO 3 (g) 280,6 0,363 0,343 0,037 0,25 0,40 0,15 Exp 5 280,5 0,568 0,066 0,132 0,70 — — Exp 4 280,0 0,143 0,026 0,053 0,20 — — Exp 3 280,7 0,135 0,332 0,014 — 0,40 0,15 Exp 2 279,2 0,170 0,155 0,030 — 0,20 0,20 Exp 1 K c [SO 3 ] [O 2 ] [SO 2 ] [SO 3 ] [O 2 ] [SO 2 ] Concentr. equilibrio (mol/l) Concentr. iniciales (mol/l)](https://image.slidesharecdn.com/quimica2bachilleratot5equilibrio-110328144211-phpapp01/85/Quimica-2-bachillerato-T5-equilibrio-11-320.jpg)
















![COCl 2 (g) CO(g) + Cl 2 (g) Inicialmente: 3 g COCl 2 en 500 mL [COCl 2 ] o = 0,061 mol/L 3. Cálculos con la constante de EQUILIBRIO](https://image.slidesharecdn.com/quimica2bachilleratot5equilibrio-110328144211-phpapp01/85/Quimica-2-bachillerato-T5-equilibrio-29-320.jpg)


![COCl 2 (g) CO(g) + Cl 2 (g) x=0,021 mol/L; [COCl 2 ]=0,04 M; [CO]=[Cl 2 ]= 0,021M 3. Cálculos con la constante de EQUILIBRIO](https://image.slidesharecdn.com/quimica2bachilleratot5equilibrio-110328144211-phpapp01/85/Quimica-2-bachillerato-T5-equilibrio-32-320.jpg)





