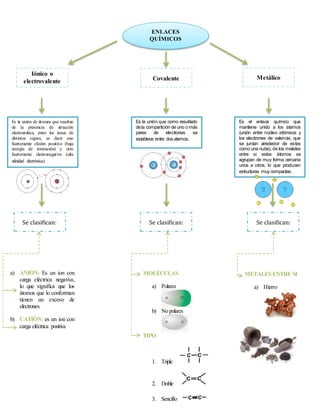
Este documento describe los diferentes tipos de enlaces químicos: iónico, covalente y metálico. Explica que el enlace iónico se produce por la atracción electrostática entre iones con cargas opuestas, mientras que el enlace covalente se forma por el intercambio o compartición de electrones entre átomos. El enlace metálico une los cationes metálicos a través de la circulación de electrones en niveles de energía comunes. También compara las propiedades de cada enlace, incluyendo sus partículas