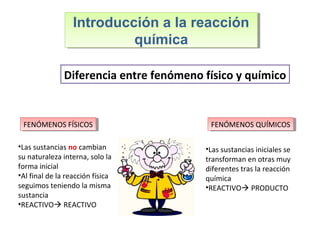
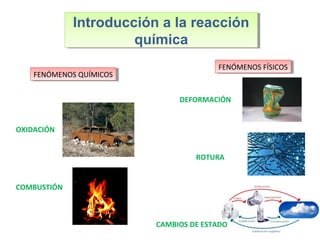
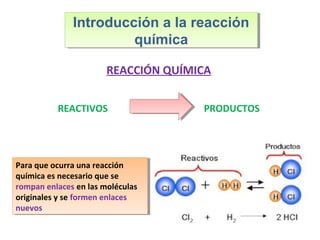
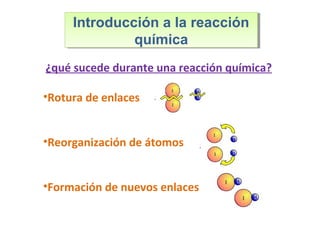
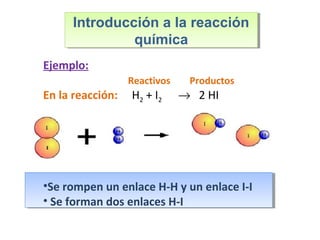
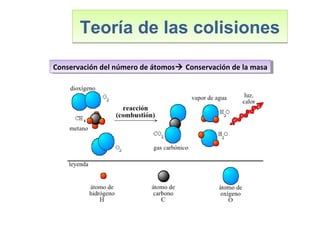
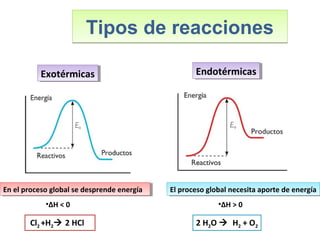
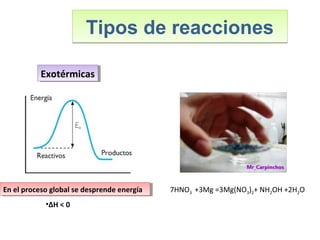
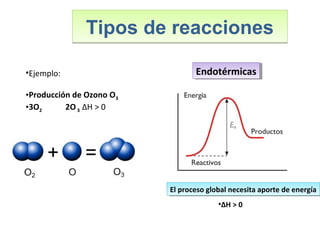
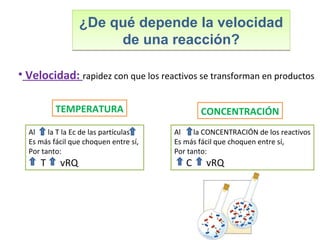
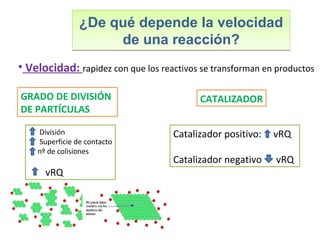
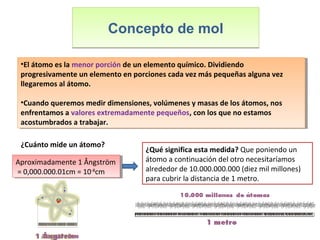
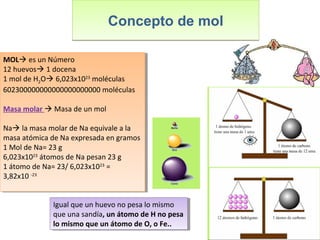
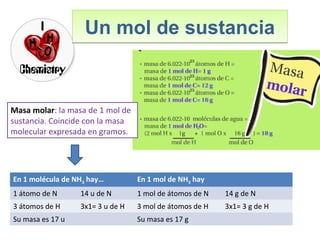
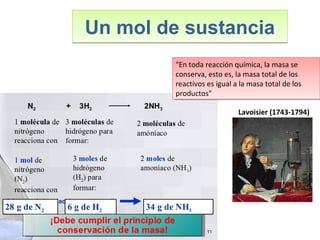
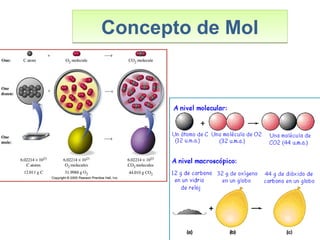
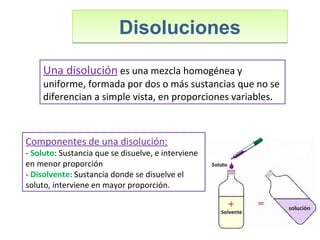
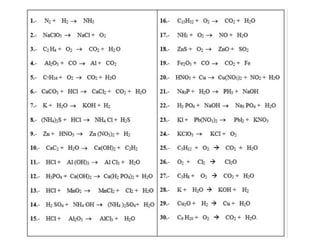
Este documento introduce los conceptos básicos de las reacciones químicas. Explica la diferencia entre fenómenos físicos y químicos, y define una reacción química como aquella en la que los reactivos originales se transforman en productos diferentes tras romper y formar enlaces. También describe los factores que afectan a la velocidad de una reacción química, como la temperatura, concentración y presencia de catalizadores.