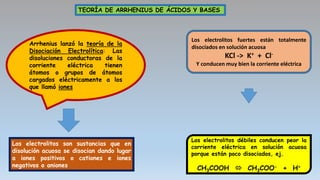
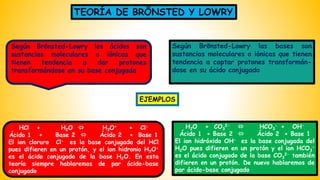
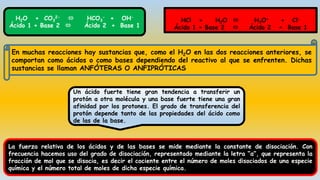
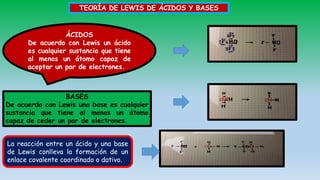
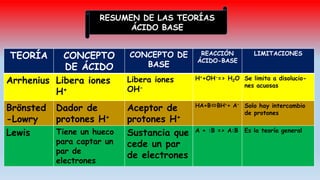
El documento describe las teorías de reacciones ácido-base en química, incluyendo la teoría de Arrhenius, Brönsted-Lowry y Lewis, así como conceptos de disociación, fuerza de ácidos y bases, y el producto iónico del agua. Se presentan ejercicios prácticos sobre el cálculo del grado de disociación y la constante de ionización de diferentes ácidos y bases. Además, se abordan temas como la valoración ácido-base, la hidrólisis de sales y la escala de pH.



![[H3O+][A-] (cα).(cα ) cα2
Ka = = =
[HA] c(1-α) 1-α
La fuerza de los ácidos y bases se mide
calculando las constantes de disociación Ka o
Kb. Expreso la constante en función de las
concentraciones molares y también del grado de
disociación α.
Veamos la Ka del equilibrio
HA + H2O H3O+ + A-
C(1-α) cα cα
[NH4
+][OH-] (cα).(cα ) cα2
Kb = = =
[NH3] c(1-α) 1-α
Veamos la constante Kb de disociación del
amoniaco para el equilibrio
NH3 + H2O NH4
++ OH-
C(1-α) cα cα](https://image.slidesharecdn.com/reaccionesacido-base-190319083530/85/Reacciones-acido-base-7-320.jpg)
![Se tiene una disolución que contiene 30,5 g/L de ácido benzoico. Calcula el grado de disociación y la
constante de ionización del ácido benzoico sabiendo que en la disolución anterior la [H3O+] = 4.10-3
mol/L. Datos: Masas atómicas : C = 12 O = 16 H = 1
g mol
Calculamos la concentración en mol/L : 30,5 ----. ------ = 0,25 mol/L
L 122 g
Concentraciones C6H5–COOH + H2O C6H5–COO- H3O+
mol/L iniciales 0,25 0 0
Variación de concentraciones -x x x
mol/L en el equilibrio 0,25 - x x X = 4.10-3
Cálculo de α : [H3O+] = cα ; 4.10-3 = 0,25 α y de aquí: α = 0,016
[C6H5–COO- ][H3O+] (4.10-3)(4.10-3)
Cálculo de la constante de ionización: Ka = ------------------------------ = --------------------------- = 6,5.10-5 mol/L
[C6H5–COOH] 0,25-4.10-3
EJERCICIO](https://image.slidesharecdn.com/reaccionesacido-base-190319083530/85/Reacciones-acido-base-8-320.jpg)
![EJERCICIO: Teniendo en cuenta que el HF es un ácido débil de Ka = 10-3,2 mol/L, calcular en qué
volumen de disolución deben estar contenidos 2 g de dicho ácido para que el pH sea 2,1.
a) ¿Cuál sería el grado de disociación α de dicho ácido?
b) Si esos 2 g estuviesen disueltos en 10 L de disolución, ¿Cuál sería el pH y el grado de disociación
en la nueva disolución? Datos: Masas atómicas F = 19 H = 1
a) HF + H2O H3O+ F-
C(1-α) cα = [H3O+] = 10-2,1 = 7,94.10-3 M cα
c α.α 7,94.10-3.α [H3O+] 7,94.10-3
Ka= ------ = ---------- = 10-3,2 = 6,3 10-4; y de aquí α = 0,073 y c = ------ = -------- = 0,108M
1- α 1- α α 0,073
2/20 c´(α´)2 0,01(α´)2
b) c´= ----- = 0,01M; Ka = ------ = ------- = 10-3,2 α´= 0,22; pH = -log[H3O+(=c´α´)] =-log(0,01.0,22)=2,65
10 1-α´ 1-α´](https://image.slidesharecdn.com/reaccionesacido-base-190319083530/85/Reacciones-acido-base-9-320.jpg)
![PRODUCTO IÓNICO DEL AGUA
H2O + H2O H3O+ + OH-
Ácido 1 + Base 2 Ácido 2 + Base 1
Vamos a poner el equilibrio de autoionización o autoprotólisis del agua, ver que
su constante Keq multiplicada por la [H2O]2 es otra constante llamada el
producto iónico del agua y representada por K(H2O).
Dado que : Keq .[H2O]2 = [H3O+].[OH-] = Cte que representamos con K(H2O)
La constante K(H2O)=[H3O+].[OH-] se llama Producto Iónico del Agua,
depende solo de la temperatura y su valor a 25ºC es 1,0.10-14 mol2. L-2](https://image.slidesharecdn.com/reaccionesacido-base-190319083530/85/Reacciones-acido-base-12-320.jpg)
![LA ESCALA DE pH
En muchos casos se trabaja con disoluciones diluidas. En ellas la concentración de iones
hidronio H3O+ expresada en mol.L-1 es pequeña, por ejemplo la [H3O+] de una solución 0,5 M
de CH3 COOH es 3.10-3 M. Sörensen introdujo el pH para dar una expresión breve de las
concentraciones de H3O+.
Sörensen definió el pH
como el menos logaritmo de
la concentración molar de
iones hidronio.
pH = - log [H3O+]
El pH de la disolución 0,5 M de CH3 COOH es pH = -log[ H3O+] = -log 3.10-3 = 2,52
Finalmente tenemos que:
Una solución es ácida si la [H3O+] > 10-7 M y el pH<7
Una solución es básica si la [H3O+] < 10-7 M y el pH>7
Una solución es neutra si la [H3O+] = 10-7 M y el pH=7](https://image.slidesharecdn.com/reaccionesacido-base-190319083530/85/Reacciones-acido-base-13-320.jpg)
![Análogamente definimos
pOH como el menos loga-
ritmo de la concentración
molar de iones hidróxido
pOH = - log[OH ]
Como el producto iónico del agua es: [H3O+].[OH-] = 1,0.10-14 . Podemos
tomar logaritmos de la expresión anterior, multiplicarla por (-1) y
obtenemos: -log [H3O+] - log [OH-] = 14 luego pH + pOH = 14
H2O + H2O H3O+ + OH-
Dado el equilibrio de autoionización o autoprotólisis del agua, si tenemos agua en un
recipiente y agregamos un ácido aumenta la concentración de H3O+ y el equilibrio anterior se
desplaza hacia la izquierda con lo que desaparecen iones OH- y son los iones H3O+ los
responsables del carácter ácido de la disolución resultante.
Si tenemos agua en un recipiente y agregamos una base aumenta la concentración de OH- y
el equilibrio anterior se desplaza hacia la izquierda con lo que desaparecen iones H3O+ y son
los iones OH- los responsables del carácter básico de la disolución resultante](https://image.slidesharecdn.com/reaccionesacido-base-190319083530/85/Reacciones-acido-base-14-320.jpg)
![EJERCICIO
Calcula el pH de una disolución de una base orgánica de concentración 0,02 mol/L sabiendo que su
pKb = 5,79
Ponemos la ecuación de ionización : B + H2O BH+ + OH-
pKb = 5,79 =-logKb => Kb = 10-5,79 = 1,62.10-6
[BH+][OH-] x2
Kb = --------- = -----= 1,62.10-6 => x = 1,8.10-4 mol/L = [OH-] pOH=-log[OH-]=-log(1,8.10-4)= 3,74
[B] 0,02-x
Luego pH = 14 – pOH = 14-3,74 = 10,26
Concentraciones B + H2O BH+
OH-
mol/L iniciales 0,02 0 0
Variación de mol/L -x x x
mol/L en el equilibrio 0,02-x x x](https://image.slidesharecdn.com/reaccionesacido-base-190319083530/85/Reacciones-acido-base-15-320.jpg)
![EJERCICIO
Se tiene una disolución acuosa de ácido acético de concentración 0,055 mol/L. Calcular: a) El pH de
dicha disolución. b) El grado de disociación. c) La concentración que tendría que tener una disolución
de ácido clorhídrico para que su pH sea igual que el de la disolución anterior. Dato: Ka = 1,86.10-5 .
[CH3–COO- ][H3O+] x2
a) Ka= ---------------- = ---------- = 1,86.10-5 ; x = 10-3 mol/L = [H3O+]
[CH3–COOH] 0,055 – x
pH = -log [H3O+] = -log10-3 = 3 ; b) [H3O+] = c α ; 10-3 = 0,055.α -> α = 0,018
c) Como el HCl es un ácido fuerte, está totalmente disociado: HCl + H2O -> H3O+ + Cl-.
Para que la [H3O+]=10-3 mol/L la concentración de HCl ha de ser igual a 10-3 mol/L
Concentraciones CH3-COOH + H2O CH3–COO- H3O+
mol/L iniciales 0,055 0 0
Variación de concentración en mol/L -x x x
mol/L en el equilibrio 0,055-x X x](https://image.slidesharecdn.com/reaccionesacido-base-190319083530/85/Reacciones-acido-base-16-320.jpg)

![HIDRÓLISIS
DE SALES
Hay sales que en
solución acuosa
presentan un pH
ácido o básico.
HIDRÓLISIS DE UNA SAL DE ÁCIDO DÉBIL Y BASE
FUERTE
Las sales en solución acuosa están totalmente disociadas.
Ej. El acetato de sodio: CH3-COONa => CH3-COO- + Na+
El ion acetato, base conjugada del ácido acético que es
débil, es una base fuerte y por tanto captará protones del
agua: CH3-COO- + H2O CH3-COOH + OH- Como vemos
en este equilibrio de hidrólisis aparecen iones OH- respon-
sables del carácter básico de las soluciones de acuosas del
CH3-COONa. La constante de hidrólisis vale
[CH3-COOH].[OH-] [H3O+] K(H2O)
Kh = * =
[CH3-COO-] [H3O+] Ka
Un ejemplo de valoración ácido-base es la reacción entre el ácido sulfúrico y el hidróxido de potasio.
La reacción que tiene lugar es: H2SO4 + 2KOH K2SO4 + 2H2O
En el punto de equivalencia se cumple que: Vácido (L) . Cácido (mol/L) . 2 = Vbase (L). Mbase .(mol/L) . 1](https://image.slidesharecdn.com/reaccionesacido-base-190319083530/85/Reacciones-acido-base-18-320.jpg)
![HIDRÓLISIS DE UNA SAL DE ÁCIDO FUERTE Y BASE DÉBIL
Hemos visto que las sales en solución acuosa están totalmente disociadas.
Veamos el ejemplo del cloruro de amonio
NH4Cl => Cl- + NH4
+
El ion amonio, ácido conjugado de la base amoniaco que es una base débil, es un
ácido fuerte y por tanto dará protones del agua:
NH4
+ + H2O H3O+ + NH3
Como vemos en este equilibrio de hidrólisis aparecen iones H3O+ responsables
del carácter ácido de las soluciones de acuosas del NH4Cl. La constante de
hidrólisis vale:
[NH3 ].[H3O+] [OH-] K(H2O)
Kh = * =
[NH4
+] [OH-] Kb
SALES DE ÁCIDO FUERTE Y BASE FUERTE
Las sales de ácido fuerte y base fuerte no experimentan hidrólisis.
Por ejemplo el NaCl se disocia así :
NaCl => Na+ + Cl-
pero ni ion sodio ni el ion cloruro reacciona con el agua.](https://image.slidesharecdn.com/reaccionesacido-base-190319083530/85/Reacciones-acido-base-19-320.jpg)
![INDICADORES ÁCIDO - BASE
Los indicadores ácido-base son generalmente ácidos o bases orgánicas débiles que cambian de color según el
pH del medio
Al añadir un indicador HIn a una solución acuosa
se produce el equilibrio:
HIn + H2O H3O+ + In-
[H3O+].[In-]
cuya constante es: Ka = ------------
[HIn]
De donde la [H3O+] = Ka [HIn]/[In-] y tomando
logaritmos y multiplicando por (-1) obtenemos
que:
[In-]
pH = pKa + log -----
[HIn]
Para que apreciemos el cambio de color,
las concentraciones en forma iónica y
molecular del indicador han de ser unas
10 veces mayor una que la otra.
Si la relación es 0,1 el:
pH = pKa + log 0,1 = pKa-1
Y si es 10 el:
pH = pKa + log 10 = pKa+1
De modo que el cambio de color se da en
un intervalo de unas 2 unidades de pH
entorno al pKa del indicador. A este
intervalo lo llamamos zona de viraje.](https://image.slidesharecdn.com/reaccionesacido-base-190319083530/85/Reacciones-acido-base-20-320.jpg)
![Solución amortiguadora CH3COOH/ CH3COONa (ácido débil y sal de dicho ácido y base fuerte)
En esta disolución amortiguadora tenemos el equilibrio
CH3COOH + H2O H3O+ + CH3COO-
y la sal que está totalmente disociada
CH3COONa -> CH3COO- + Na+
Al añadir un ácido aumenta la [H3O+] y el equilibrio se desplaza hacia la izquierda (de acuerdo con
el principio de Le Chatelier) ya que tenemos muchos iones CH3COO- mayormente aportados por la
sal que está totalmente disociada. De esta manera los H3O+ “desaparecen” puesto que con los iones
CH3COO- dan lugar a CH3COOH sin disociar y por tanto no se produce un cambio significativo del
pH.
Al añadir una base aumenta la [OH-] y se produce la reacción: CH3COOH + OH--> CH3COO- + H2O
De esta manera los OH- “desaparecen” puesto que reaccionan con el CH3COOH dando lugar a
CH3COO- y por tanto no se produce un cambio significativo del pH.
Podemos calcular el pH de la forma siguiente: Ka= [H3O+].[CH3COO-]/[CH3COOH]
Despejamos la [H3O+] ; [H3O+] = Ka [CH3COOH]/[CH3COO-] y tomando logaritmos y multiplicando
por (-1) obtenemos que:
pH = pKa + log[CH3COO-]/[CH3COOH]
DISOLUCIONES AMORTIGUADORAS
Disoluciones amortiguadoras, reguladoras, tampón o buffer son disoluciones que mantienen el pH prácticamente
constante ante la adición de un ácido o una base.](https://image.slidesharecdn.com/reaccionesacido-base-190319083530/85/Reacciones-acido-base-21-320.jpg)
![DISOLUCIONES AMORTIGUADORAS
Solución amortiguadora NH3/NH4Cl (base débil y sal de dicha base y ácido fuerte)
En esta disolución tenemos el equilibrio
NH3 + H2O NH4
+ + OH-
y la sal que está totalmente disociada:
NH4Cl -> Cl- + NH4
+
Al añadir una base aumenta la [OH-] y el equilibrio se desplaza hacia la izquierda (de acuerdo con el
principio de Le Chatelier) ya que tenemos muchos iones NH4
+ mayormente aportados por la sal, que
está totalmente disociada. De esta manera los OH- “desaparecen” puesto que con los iones NH4
+ dan
lugar a NH3 sin disociar y por tanto no se produce un cambio significativo del pH.
Al añadir un ácido el equilibrio se desplaza hacia la derecha (de acuerdo con el principio de Le
Chatelier) ya que con el H2O produce iones H3O+ que se combinarían con los iones OH- . De esta
manera los H3O+ “desaparecen” y por tanto no se produce un cambio significativo del pH.
Podemos calcular el pOH de la forma siguiente: Dado que Kb =[NH4
+][OH-]/[NH3]
Despejamos la [OH-] ; [OH-] = Kb [NH3]/[NH4
+] y tomando logaritmos y multiplicando por
(-1) obtenemos que:
[NH4
+] [NH3]
pOH = pKb + log ------ y el pH ; pH = 14 – pOH = 14 - pKb + log ------
[NH3] [NH4
+]](https://image.slidesharecdn.com/reaccionesacido-base-190319083530/85/Reacciones-acido-base-22-320.jpg)
![EJERCICIO.-Se prepara una disolución amortiguadora disolviendo 0,2 moles de ácido metanoico y 0,4
moles de metanoato de sodio en agua hasta obtener 1 L de disolución. Calcular:
a) El pH de la disolución sabiendo que la constante de disociación del ácido metanoico vale 1,8.10-4.
b) ¿Qué pH tendrá la disolución después de añadir 0,02 moles de HCl?
c) ¿Qué pH tendrá la disolución original después de añadir 0,02 moles de NaOH?
La sal HCOONa está totalmente disociada o sea tenemos 0,4 moles de HCOO- y 0,4 moles de Na+
Concentraciones HCOOH + H2O HCOO- H3O+
mol/L iniciales 0,2 0,4 0
Se disocian x mol/L de ácido metanoico -x X x
mol/L en el equilibrio 0,2-x ~ 0,2 O,4 + X ~ 0,4 x
[HCOO-][H3O+] 0,4.x
a) Ka = ------------ = ------ = 1,8.10-4 luego x = 9.10-5 = [H3O+] y pH =-log[H3O+] =-log 9.10-5 = 4,05
[HCOOH] 0,2
Concentraciones HCOOH + H2O HCOO- H3O+
mol/L iniciales 0,2+0,02=0,22 0,4-0,02= 0,38 0
Se disocian x mol/L de ácido metanoico -x X x
mol/L en el equilibrio 0,22-x ~ 0,22 O,38 + X ~ 0,38 x](https://image.slidesharecdn.com/reaccionesacido-base-190319083530/85/Reacciones-acido-base-23-320.jpg)
![CONTINUACIÓN DEL EJERCICIO DE LA DIAPOSITIVA ANTERIOR
b) En la tabla anterior se ha tenido en cuenta la reacción: HCl + HCOONa -> HCOOH + NaCl de
modo que al añadir 0,02 moles de HCl, han producido 0,02 moles de HCOOH y han disminuido en 0,02
moles la cantidad de HCOONa. Por tanto tenemos de HCOOH 0,2 + 0,02 = 0,22 moles y de HCOONa
0,4-0,02 = 0,38 moles inicialmente y ahora se disocian x mol/L de HCOOH.
[HCOO-][H3O+] 0,38.x
b) Ka=------------- = ------- = 1,8.10-4 luego x=1,04.10-4=[H3O+] y pH=-log[H3O+]=-log1,04.10-4 = 3,98
[HCOOH] 0,22
c) Al agregar 0,02 moles de NaOH hay que tener en cuenta que: HCOOH + NaOH-> HCOONa + H2O
Por ello van a producirse 0,02 moles de HCOONa y como había 0,4 moles de HCOONa vamos a tener
0,42 moles de HCOONa y la cantidad inicial de HCOOH que era 0,2 moles va a disminuirse en 0,02
moles o sea que tendremos 0,18 moles de HCOOH de los que se van a disociar “x”
Concentraciones HCOOH + H2O HCOO- H3O+
mol/L iniciales 0,2-0,02=0,18 0,4+0,02= 0,42 0
Se disocian x mol/L de ácido metanoico -x X x
mol/L en el equilibrio 0,18-x ~ 0,18 O,42 + X ~ 0,42 x
Ka = 0,42.x/0,18 = 1,8.10-4 -> x = 7,7.10-5 mol/L = [H3O+] ->pH = -log 7,7.10-5 = 4,11](https://image.slidesharecdn.com/reaccionesacido-base-190319083530/85/Reacciones-acido-base-24-320.jpg)
![EJERCICIO
Calcular la variación de pH que se producirá en 90 mL de disolución amortiguadora 0,17 M en NH3 y
0,18 M en NH4Cl, al añadirle 10 mL de disolución 0,1 M de HCl suponiendo que los volúmenes son
aditivos.
Dato: Constante de ionización del amoníaco Kb = 1,8.10-5
En la disolución amortiguadora tenemos el equilibrio siguiente: NH3 + H2O NH4
+ + OH-
Y el NH4Cl, sal soluble que está totalmente disociada: NH4Cl -> Cl- + NH4
+
Calcularemos el pH de la solución amortiguadora: Como la [NH3] = 0,17 mol/L y [NH4
+] = 0,18 mol/L
el pH;
pH =14 - pKb + log [NH3]/[NH4
+] = 14 – log (1,8.10-5) + log (0,17/0,18) = 9,231
Moles iniciales de NH3: V.M = 0,090 L . 0,17 mol/L = 0,0153
Moles iniciales de NH4Cl: V.M = 0,090 L .0,18 mol/L = 0,0162
Moles de HCl añadidos: V.M = 0,010 L . 0,1 mol/L = 0,001
La reacción que tiene lugar es : HCl + NH3 -> NH4Cl
Moles de NH3 después de agregar HCl: 0,0153-0,001 = 0,0143 => [NH3] = 0,0143/0,1 = 0,143 mol/L
Moles de NH4Cl después de agregar HCl: 0,0162+0,001 = 0,0172 => [NH4Cl] =0,0172/0,1 = 0,172 mol/L
pH = 14-log (1,8.10-5) + log (0,143/0,172) = 9,176 : Luego ΔpH = 9,231 - 9,176 = 0,055](https://image.slidesharecdn.com/reaccionesacido-base-190319083530/85/Reacciones-acido-base-25-320.jpg)
![Calcular la variación de [H3O+ ] que se produce al añadir 1 mL de HCl de concentración 1 mol/L a un
litro de disolución amortiguadora cuya [CH3COOH] = 0,7 mol/L y cuya [CH3COO-] = 0,6 mol/L.
Datos: Ka = 1,8.10-5
En la disolución amortiguadora tenemos el equilibrio: CH3COOH + H2O H3O+ + CH3COO- y además
tenemos iones CH3COO- en concentración 0,6 mol/L
La [H3O+]=Ka.[CH3COOH]/[CH3COO-] =1,8.10-5.(0,7/0,6) =2,1.10-5 mol/L
Calculamos las nuevas concentraciones al añadir 1 mL de HCl 1M: V.M=0,001.1=0,001 moles de HCl
La reacción que tiene lugar al añadir HCl es: CH3COO- + H3O+ -> CH3COOH +H2O
La nueva [CH3COOH]=0,7+0,001=0,701mol/L ; La nueva [CH3COO-] = 0,6-0,001 = 0,599 mol/L
Y la nueva [H3O+] es: [H3O+] = Ka.[CH3COOH]/[CH3COO-] = 1,8.10-5.(0,701/0,599) = 2,1.10-5 mol/L
Con lo que no se produce una variación apreciable de la [H3O+] (habría que tomar más decimales para
apreciar la variación). Por lo que la variación del pH es muy pequeña, lo que es esperable dado que
agregamos el ácido a una disolución amortiguadora.
EJERCICIO](https://image.slidesharecdn.com/reaccionesacido-base-190319083530/85/Reacciones-acido-base-26-320.jpg)
