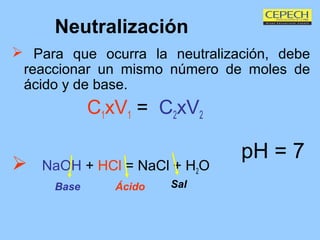
El documento presenta los conceptos básicos de ácidos y bases, incluyendo las teorías de Arrhenius, Lowry-Brönsted y la escala de pH. Explica que los ácidos donan iones hidrógeno mientras que las bases los aceptan, y que la neutralización ocurre cuando un ácido y una base reaccionan en cantidades equivalentes para formar una sal y agua. También cubre cómo calcular el pH y pOH de soluciones y realizar cálculos de neutralización.


















![Medida de acidez y alcalinidad pH = -log [ H + ] pOH = -log [ OH - ] pH + pOH = 14](https://image.slidesharecdn.com/acidobase-101121103210-phpapp02/85/Acido-base-19-320.jpg)
![Medida de acidez y alcalinidad Región ácida Región neutra Región básica [H + ] > [OH - ] [H+] = [OH-] [H+] < [OH-]](https://image.slidesharecdn.com/acidobase-101121103210-phpapp02/85/Acido-base-20-320.jpg)

![Medida de acidez pH corresponde a la concentración de protones que libera un ácido al medio, ya sea por disociación total o parcial. pH = -log [ H + ]](https://image.slidesharecdn.com/acidobase-101121103210-phpapp02/85/Acido-base-22-320.jpg)
![Medida de acidez Una solución de HNO 3 tiene una concentración 0,01 M. ¿Cuál es su pH? Disociación: HNO 3 -> H + + NO 3 - Concentración: 0,01M 0,01M 0,01M pH = -log [H + ] pH = -log 0,01 pH = -log 10 -2 pH = - (-2) log 10 pH = 2 solución ácida](https://image.slidesharecdn.com/acidobase-101121103210-phpapp02/85/Acido-base-23-320.jpg)
![Medida de alcalinidad pOH corresponde a la concentración de iones hidroxilo que libera una base al medio, ya sea por disociación total o parcial. pOH = -log [ OH - ] pH + pOH = 14](https://image.slidesharecdn.com/acidobase-101121103210-phpapp02/85/Acido-base-24-320.jpg)
![Medida de alcalinidad Una solución de NaOH tiene una concentración 0,1 M. ¿Cuál es su pH? Disociación: NaOH -> Na + + OH - Concentración: 0,1M 0,1M 0,1M pOH = -log [OH - ] pOH = -log 0,1 pOH = -log 10 -1 pOH = - (-1) log 10 pOH = 1 pH = 13 solución básica](https://image.slidesharecdn.com/acidobase-101121103210-phpapp02/85/Acido-base-25-320.jpg)