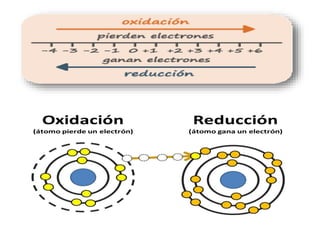
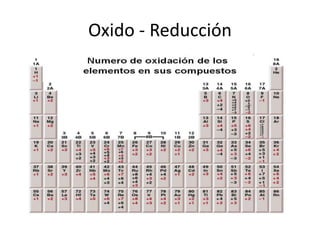
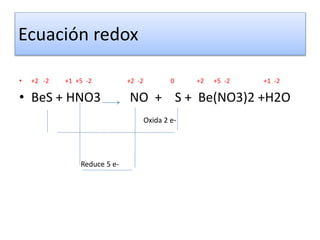
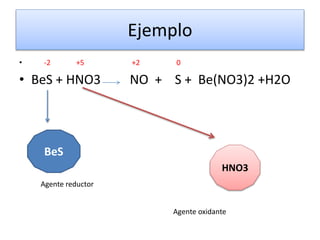
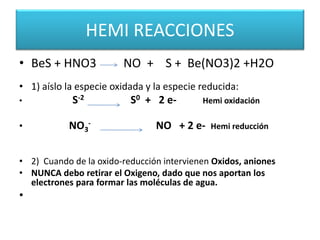
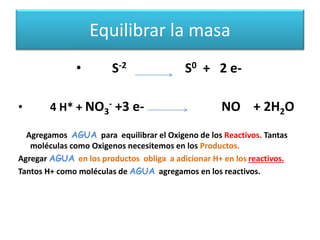
Este documento trata sobre las reacciones de óxido-reducción. Explica que son reacciones químicas importantes que ocurren en nuestro entorno y nos permiten obtener energía. Describe ejemplos como la combustión y la corrosión. Además, define los conceptos de óxido, reducción, estados de oxidación y cómo equilibrar reacciones redox.