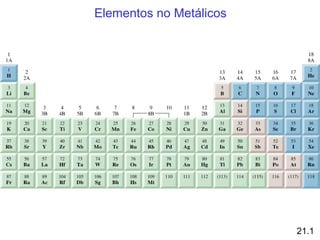
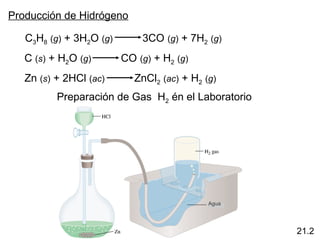
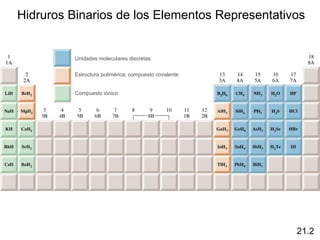
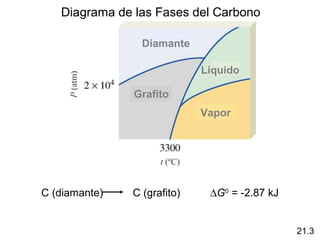
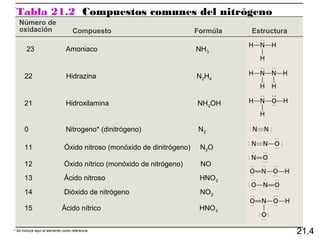
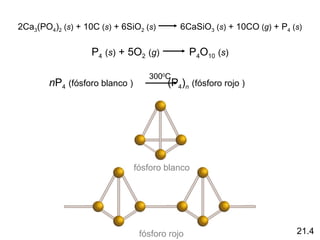
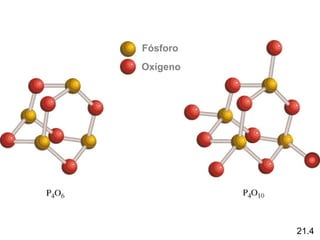
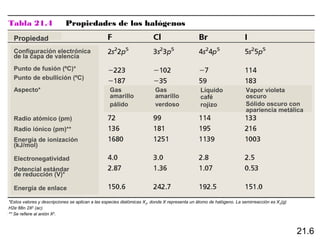
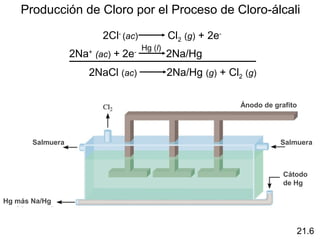
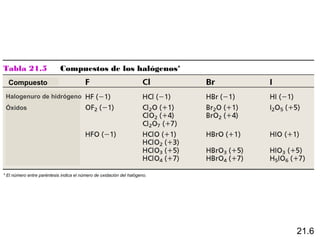
Este documento trata sobre los elementos no metálicos y sus compuestos. Explica la producción de hidrógeno a través de varias reacciones químicas, e introduce los hidruros binarios de los elementos representativos. También cubre los isótopos del hidrógeno, la economía del hidrógeno y las fases del carbono. Posteriormente, describe la producción de gas sintético a partir del carbón, compuestos comunes del nitrógeno, fósforo y azufre, así como procesos para su obtención. Finalmente