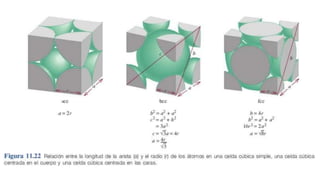
Este documento describe los diferentes tipos de sólidos, incluyendo sólidos cristalinos, amorfos, iónicos, moleculares y metálicos. Los sólidos pueden clasificarse como cristalinos u amorfos dependiendo del orden de los átomos, y como iónicos, moleculares o metálicos dependiendo de las fuerzas entre las partículas. Los sólidos cristalinos tienen átomos ordenados en una red repetitiva, mientras que los amorfos carecen de orden.