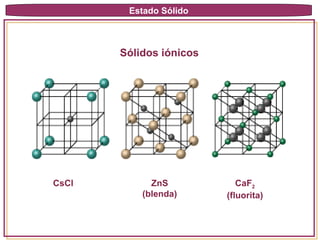
Los sólidos se caracterizan por tener fuerzas intermoleculares intensas que causan que conserven su forma y volumen. Pueden ser cristalinos u amorfos, dependiendo de si las partículas que los componen se encuentran ordenadas o no. Los sólidos cristalinos presentan una red tridimensional ordenada, mientras que los amorfos carecen de orden a larga distancia. Las propiedades de los sólidos dependen del tipo y orden de las partículas que los forman y de las fuerzas entre ellas.