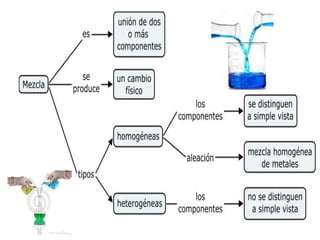
El documento proporciona información sobre las mezclas homogéneas y heterogéneas, explicando que las mezclas homogéneas tienen una sola fase física mientras que las heterogéneas tienen más de una. Luego define las soluciones como mezclas homogéneas formadas por un soluto y un solvente sin reacción química. Finalmente, describe diferentes formas de expresar la concentración de una solución, incluyendo porcentaje en masa y volumen.