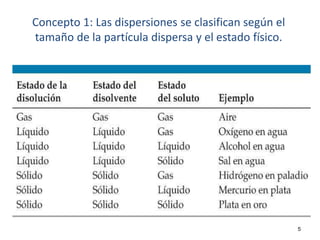
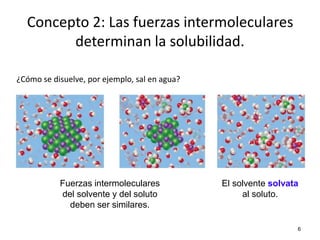
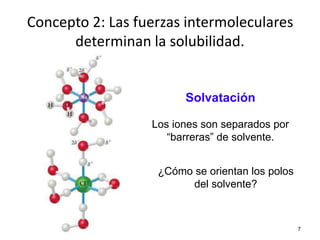
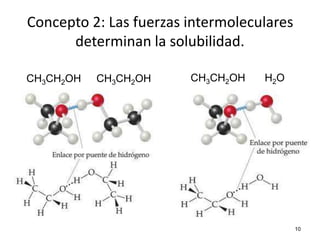
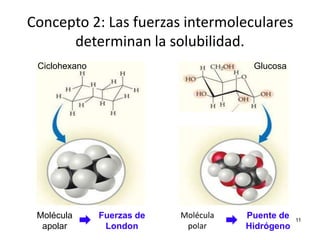
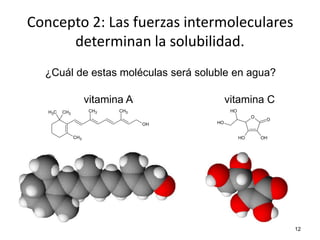
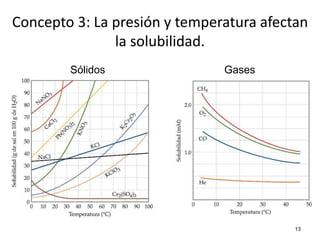
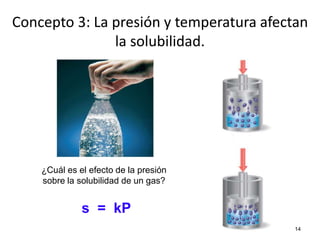
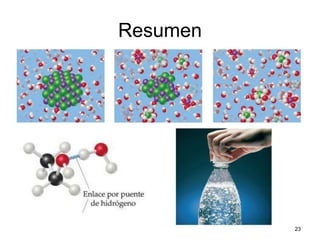
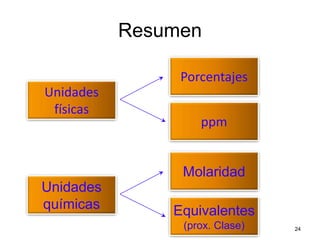
El documento resume cuatro conceptos clave sobre soluciones y unidades de concentración. Explica cómo las dispersiones se clasifican según el tamaño de partícula y estado físico, cómo las fuerzas intermoleculares determinan la solubilidad, cómo la presión y temperatura afectan la solubilidad, y cómo se expresa cuantitativamente la concentración de soluciones a través de porcentajes, partes por millón y molaridad.