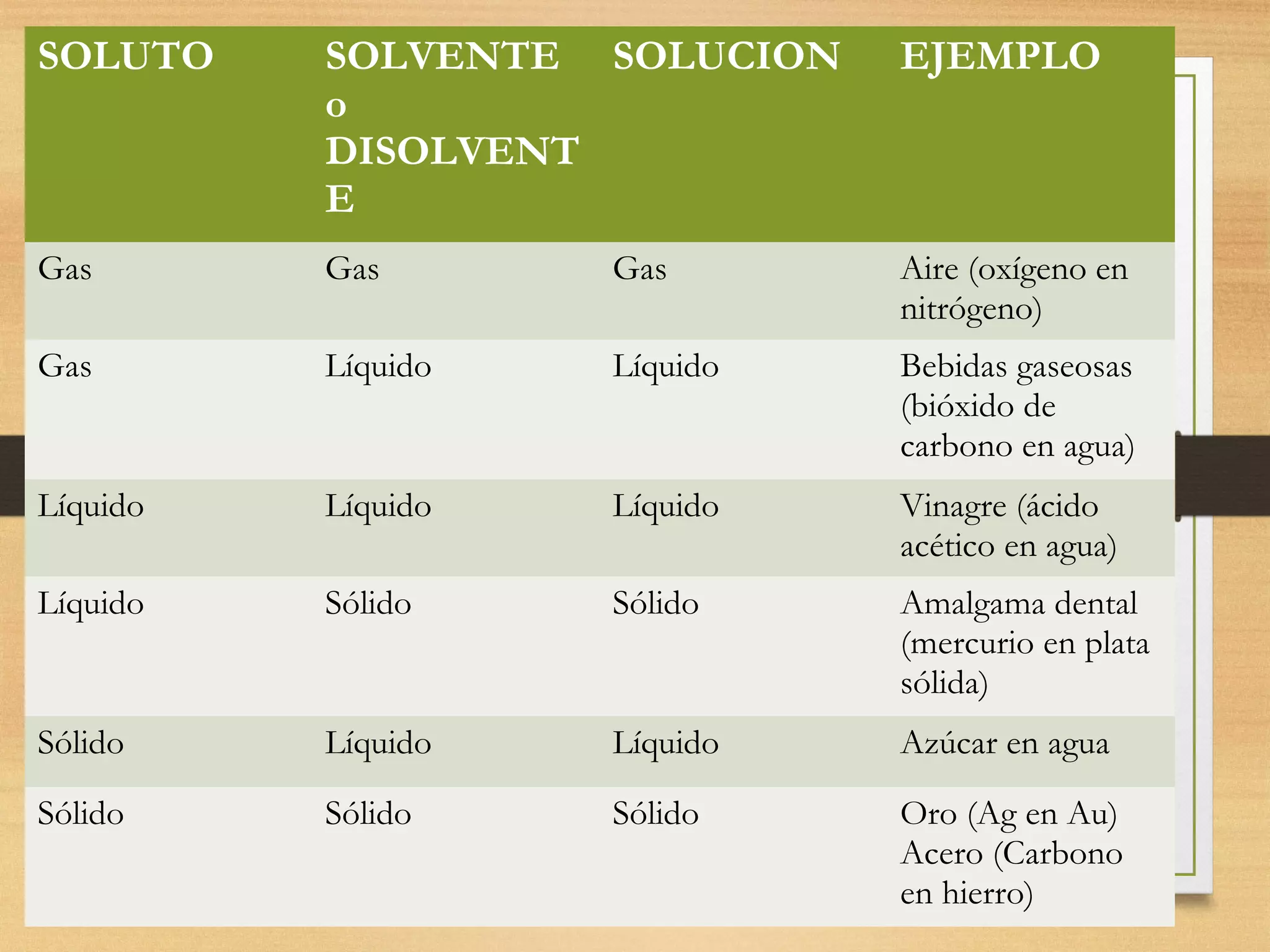
Este documento describe diferentes tipos de mezclas químicas. Define una solución como una mezcla homogénea de dos o más sustancias. Explica que una solución tiene un solvente como componente mayoritario y uno o más solutos como componentes minoritarios. Además, detalla diferentes formas de expresar la concentración de una solución, incluyendo la molaridad, porcentaje en masa y volumen, entre otras unidades.