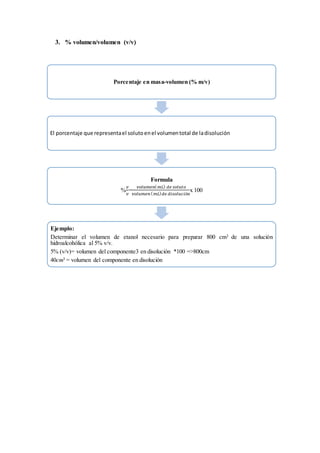
El documento define una solución como una mezcla homogénea de sustancias que consiste en un solvente y uno o más solutos. Explica que el solvente es el medio en que los solutos se disuelven y que las unidades fundamentales de solutos son normalmente iones o moléculas. Además, describe diferentes tipos de soluciones como el agua de mar y la sangre, e indica que las concentraciones de soluciones pueden expresarse en porcentaje masa/masa, masa/volumen, volumen/volumen, partes por millón y partes