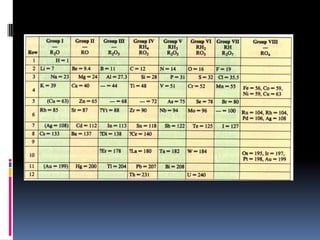
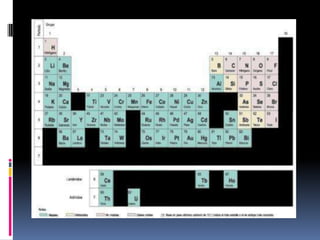
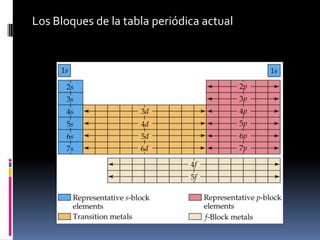
El documento resume la historia del desarrollo de la tabla periódica de los elementos. Johann Dobereiner clasificó elementos en grupos de tres llamados triadas con propiedades químicas y físicas similares en 1829. John Newlands propuso ordenar los elementos en "octavas" basado en su masa atómica en 1863. Dmitri Mendeleev publicó la primera tabla periódica ordenada por masa atómica en 1869. Lothar Meyer publicó una tabla similar al mismo tiempo. Henry Moseley determinó el número atómico como la base







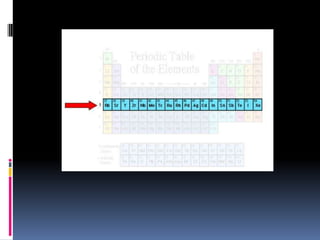
![Grupo IIA (2)
Be [He]2s2
Mg [Ne]3s2
Ca [Ar]4s2
Sr [Kr]5s2
Ba [Xe]6s2
Ra [Rn]7s2
ns2](https://image.slidesharecdn.com/tablaperidica-130908182715-/85/Tabla-periodica-12-320.jpg)

