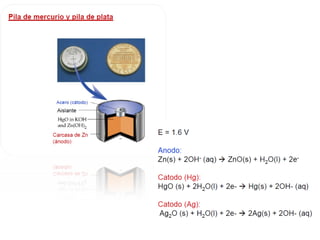
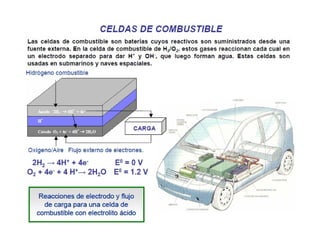
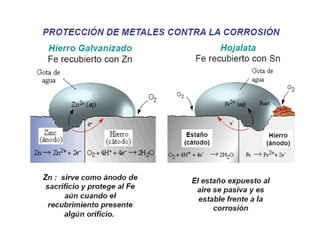
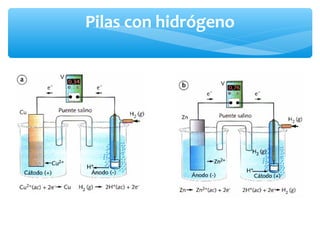
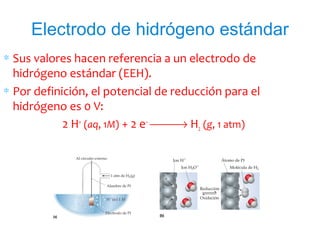
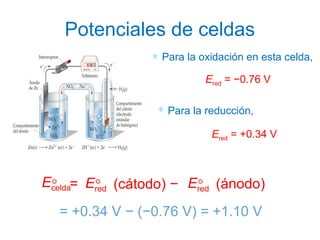
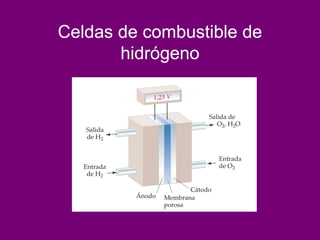
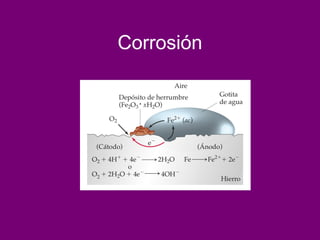
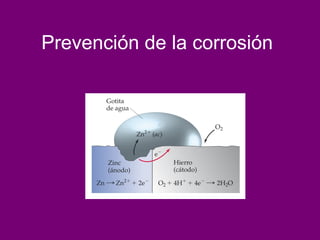
El documento describe conceptos clave de las reacciones redox como estado de oxidación, oxidación y reducción, y equilibrio redox. Explica el funcionamiento de baterías como la pila Daniell y pilas comerciales. También cubre electrólisis, fuerza electromotriz, potenciales de reducción estándar, ecuación de Nernst y ecuación de Faraday.