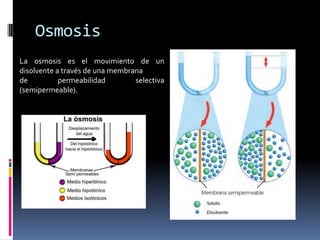
Este documento resume las propiedades coligativas de las soluciones, incluyendo la disminución de la presión de vapor, el aumento del punto de ebullición, la disminución del punto de congelación y la presión osmótica. Proporciona ejemplos de cálculos para cada una de estas propiedades y explica cómo se ven afectadas por factores como la concentración y la temperatura. También define conceptos clave como la molalidad, la fracción molar y el factor de Van't Hoff.