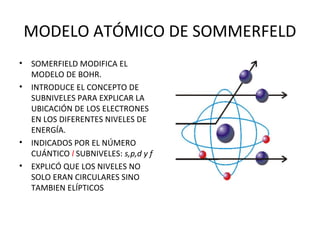
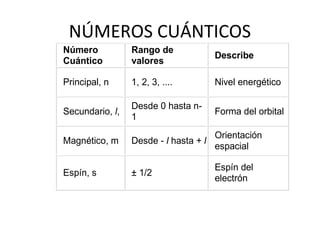
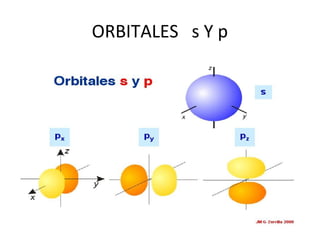
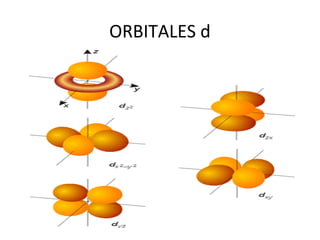
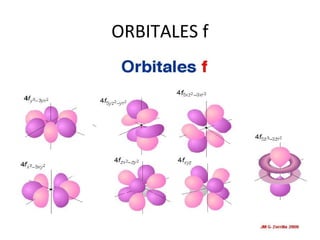
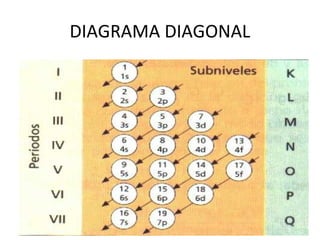
El documento describe el modelo atómico de Sommerfeld, que modificó el modelo de Bohr introduciendo el concepto de subniveles para explicar la ubicación de los electrones en diferentes niveles de energía. También describe los principios de dualidad onda-partícula, la naturaleza ondulatoria del electrón propuesta por Louis de Broglie, e introduce los números cuánticos y su significado en la ecuación de Schrödinger para describir el comportamiento de los electrones.