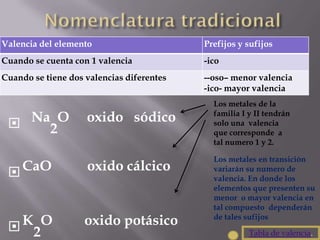
La nomenclatura química establece reglas para nombrar compuestos químicos, facilitando recordar sus componentes y funciones. Incluye diferentes categorías, como óxidos metálicos y no metálicos, ácidos, hidróxidos y sales, cada una con características específicas de nomenclatura dependiendo de sus valencias. Se utilizan prefijos griegos para indicar la cantidad de átomos en compuestos y se mencionan ejemplos y confusiones comunes en la nomenclatura.