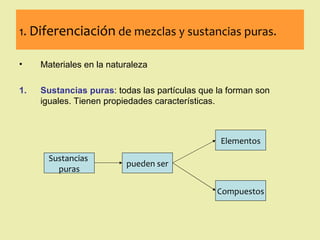
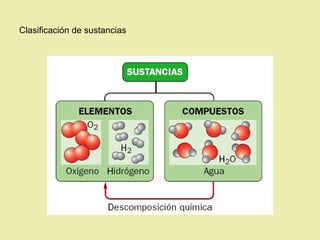
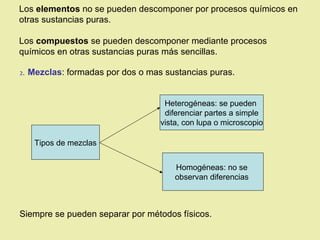
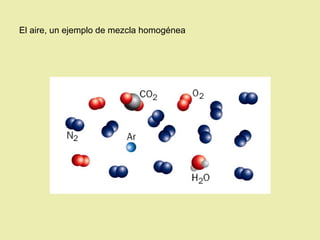
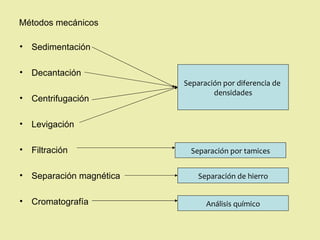
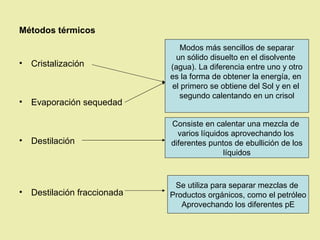
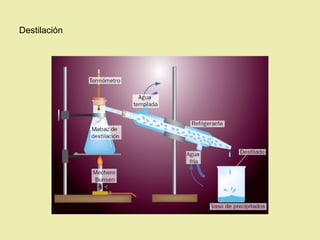
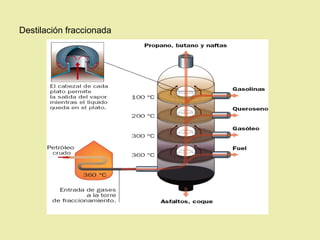
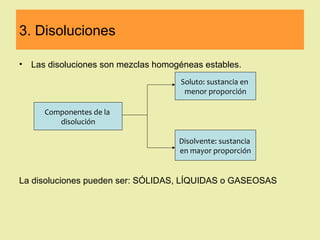
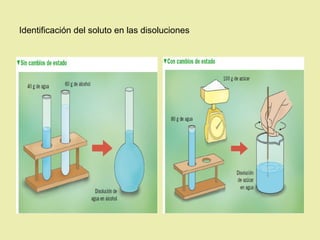
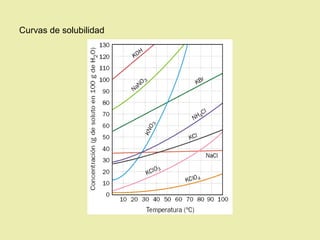
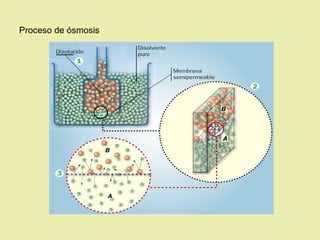
Este documento describe diferentes tipos de materiales, incluyendo sustancias puras, mezclas y disoluciones. Explica que las sustancias puras pueden ser elementos o compuestos, mientras que las mezclas están formadas por dos o más sustancias puras y siempre se pueden separar por métodos físicos. También describe varios métodos para separar mezclas heterogéneas y homogéneas, como la sedimentación, destilación y evaporación. Finalmente, explica las propiedades de las disoluciones, incluida la solubilidad y prop