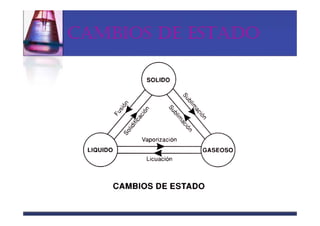
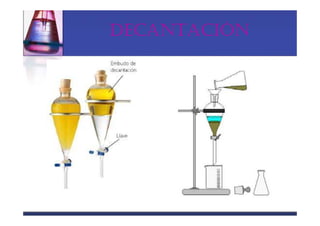
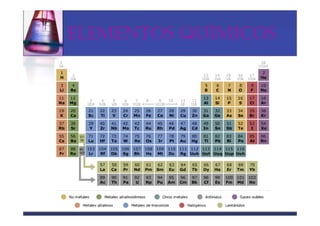
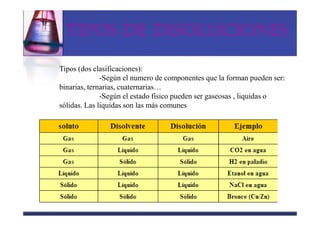
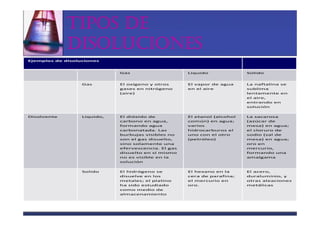
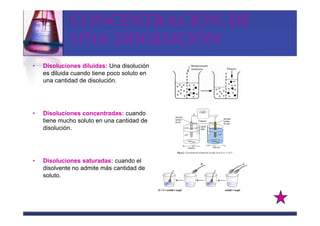
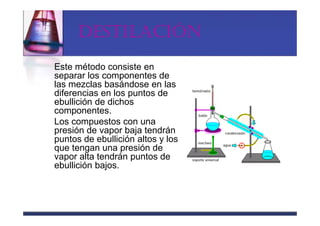
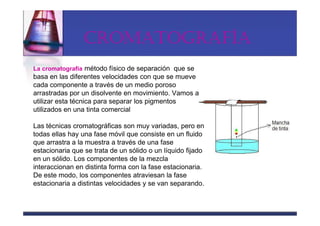
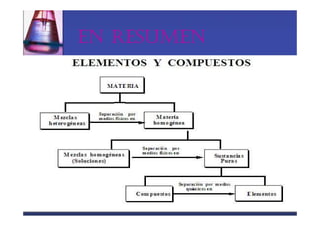
Este documento trata sobre los sistemas materiales y las propiedades de la materia. Explica que los sistemas materiales pueden ser homogéneos u heterogéneos, y que las mezclas pueden ser homogéneas (disoluciones) u heterogéneas. También describe los diferentes tipos de disoluciones y métodos para separar los componentes de las mezclas y disoluciones.