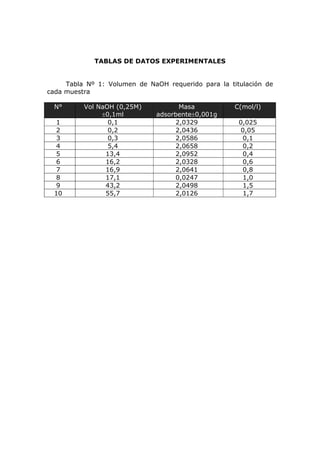
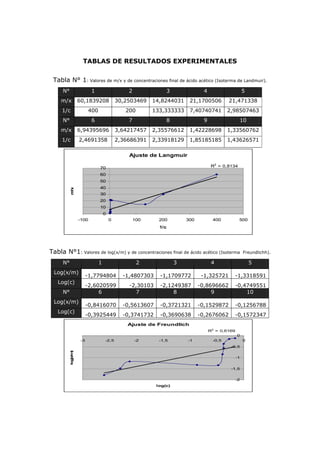
Este documento presenta los resultados de un experimento de laboratorio sobre la adsorción de ácido acético diluido en soluciones acuosas utilizando carbón activado como adsorbente. Se prepararon 10 soluciones de diferentes concentraciones y se midió la cantidad de ácido acético adsorbido por el carbón. Los datos experimentales se ajustaron a las isotermas de Langmuir y Freundlich para determinar qué modelo describe mejor el proceso de adsorción. El análisis mostró que la isoterma de Langmuir tuvo un mejor ajuste, a