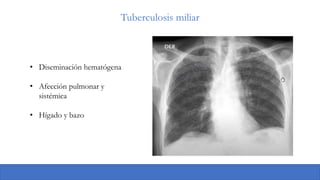
La tuberculosis sigue siendo un problema de salud pública mundial y en Colombia. En 2019 hubo 10 millones de casos de tuberculosis a nivel mundial y 11,390 casos en Colombia en 2020, siendo la forma pulmonar la más común. Los factores de riesgo incluyen VIH, desnutrición, diabetes y hacinamiento. El diagnóstico incluye baciloscopias, cultivos y pruebas moleculares, y el tratamiento consiste en una fase intensiva y de continuación con múltiples medicamentos durante varios meses. La tuberculosis latente también representa un ries