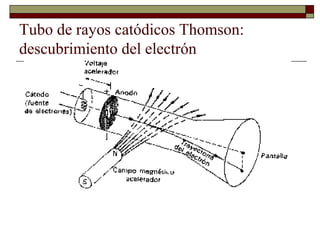
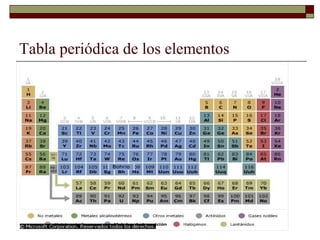
El documento presenta una introducción a la teoría atómica, desde las primeras ideas de Demócrito hasta el descubrimiento de la estructura atómica en el siglo XX. Explica los postulados de Dalton sobre los átomos y cómo experimentos como el tubo de rayos catódicos llevaron al descubrimiento del electrón y al cálculo de su masa. También resume los experimentos clave de Rutherford que condujeron a la comprensión del núcleo atómico y la visión moderna de la estructura del átomo con